Электродный потенциал – это разность электростатических потенциалов между электролитом и электродом. Возникновение такого потенциала обусловлено пространственным разделением зарядов, которые имеют противоположные знаки на границе разделения фаз с образованием электрического двойного слоя.
Пространственное разделение зарядов на границе между металлическим электродом и
раствором электролита связано с такими явлениями, как перенос ионов из металла в раствор в процессе установления электрохимического равновесия, а также адсорбция ионов из электролита на поверхность электрода; смещение газа за пределы ионной положительно заряженной кристаллической решетки; некулоновская адсорбция ионов или молекул жидкости на электроде. Благодаря последним двум явлениям электродный потенциал никогда не бывает равным нулю, даже при условии, когда заряд металлической поверхности равняется
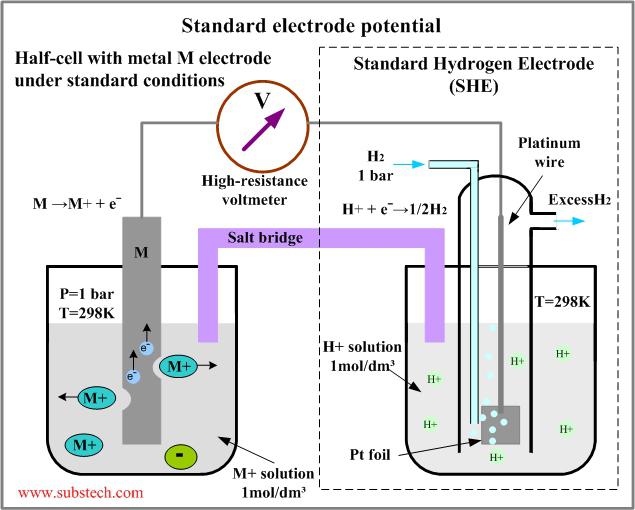
нулю. Абсолютная величина потенциала отдельно взятого электрода не определяется, для этого применяют метод сравнения эталонного и исследуемого электродов. Электродный потенциал приравнивается к величине
электродвижущей силы (ЭДС), полученной в электрохимической цепи.
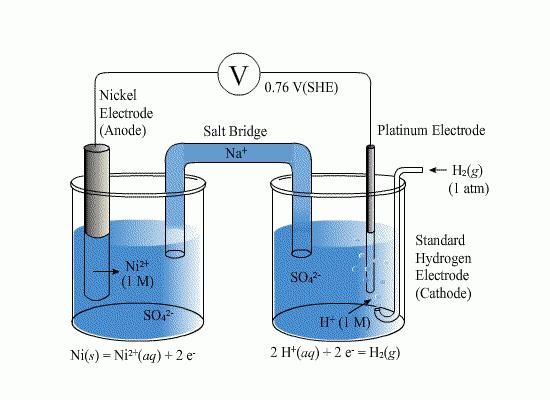
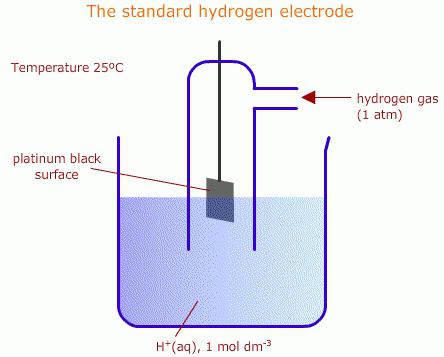
Для растворов на водной основе принято использовать водородные электроды. Стандартные элементы такого типа применяют в качестве эталонов при разнообразных электрохимических измерениях, а также в гальванических устройствах. Водородный электрод – это проволока или пластина из металла, который хорошо поглощает газообразный водород (часто используют палладий или платину). Такая пластина-проволока насыщается при атмосферном давлении водородом, после чего погружается в водный раствор, богатый ионами водорода. Потенциал такой пластины пропорционален концентрации ионов в растворе. Элемент является эталоном, относительно него отсчитывается электродный потенциал химической реакции.
При сборке гальванических элементов на базе водородного и определяемого приборов на поверхности металла платиновой группы протекает реакция (обратимая), что означает или процесс восстановления, или окисления. Тип процесса зависит от потенциала протекающей реакции определяемого элемента. Потенциал водородного электрода принимают равным нулю, когда давление водорода составляет одну атмосферу, концентрация протонов раствора – один моль на литр, а температура – 298 К. Если исследуемый элемент в эталонных условиях, то есть когда активность ионов, влияющих на потенциал, составляет единицу, а давление газа - 0,101 МПа, значение такого потенциала называют стандартным.
Измеряя ЭДС гальванического электрода в стандартных условиях, вычисляют стандартный электродный потенциал химической реакции. Обычно эту величину измеряют в условиях, когда все термодинамические активности потенциалопределяющей реакции равны единице, а
давление газа составляет 0,01*105Па. Потенциал проверяемого элемента считают положительным, если в режиме «источника тока» во внешней цепи слева направо движутся электроны, а в электролите - положительно заряженные частицы.