Особенности строения ацетилена влияют на его свойства, получение и применение. Условное обозначение состава вещества — С2Н2 — это его простейшая и брутто-формула. Ацетилен образован двумя атомами углерода, между которыми возникает тройная связь. Ее наличие отражают разные виды формул и моделей молекулы этина, позволяющих разобраться в проблеме влияния строения на свойства вещества.
Алкины. Общая формула. Ацетилен
Углеводороды алкины, или ацетиленовые, являются ациклическими, непредельными. Цепочка атомов углерода — не замкнутая, в ней присутствуют простые и кратные связи. Состав алкинов отражает сводная формула CnH2n – 2. В молекулах веществ этого класса присутствует одна или несколько тройных связей. Ацетиленовые соединения относятся к ненасыщенным. Это означает, что только одна валентность углерода реализуется за счет водорода. Оставшиеся три связи используются при взаимодействии с другими атомами углерода.
Первый - и наиболее известный представитель алкинов - ацетилен, или этин. Тривиальное название вещества произошло от латинского слова «acetum» — «уксус» и греческого — «hyle» — «дерево». Родоначальник гомологического ряда был открыт в 1836 году в химических опытах, позже вещество синтезировали из угля и водорода Э. Дэви и М. Бертло (1862 год). При обычной температуре и нормальном атмосферном давлении ацетилен находится в газообразном состоянии. Это бесцветный газ, без запаха, малорастворимый воде. Этин легче растворяется в этаноле и ацетоне.
Молекулярная формула ацетилена
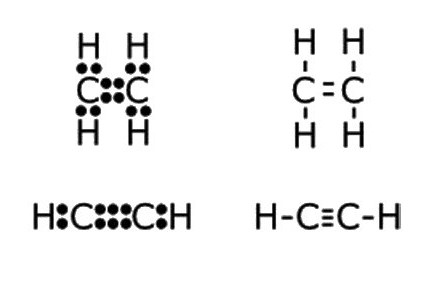
Этин — простейший член своего гомологического ряда, его состав и строение отражают формулы:
- С2Н2 — молекулярная запись состава этина, которая дает представление о том, что вещество образовано двумя углеродными атомами и таким же числом атомов водорода. По этой формуле можно рассчитать молекулярную и молярную массы соединения. Mr (С2Н2) = 26 а. е. м., М (С2Н2) = 26,04 г/моль.
- Н:С:::С:Н — электронно-точечная формула ацетилена. Подобные изображения, получившие название «структуры Льюиса», отражают электронное строение молекулы. При написании необходимо соблюдать правила: атом водорода стремится при образовании химической связи обладать конфигурацией валентной оболочки гелия, другие элементы — октетом внешних электронов. Каждое двоеточие означает общую для двух атомов или неподеленную пару электронов внешнего энергетического уровня.
- H—C≡C—H — структурная формула ацетилена, отражающая порядок и кратность связей между атомами. Одна черточка заменяет собой одну пару электронов.
Модели молекулы ацетилена
Формулы, показывающие распределение электронов, послужили фундаментом для создания атомно-орбитальных моделей, пространственных формул молекул (стереохимических). Еще в конце XVIII века получили распространение шаростержневые модели - например, шарики разного цвета и размера, обозначающие углерод и водород, которые образуют ацетилен. Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
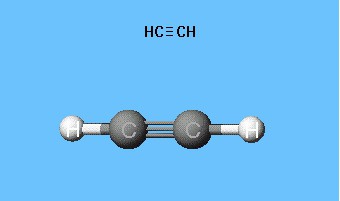
Шаростержневая модель ацетилена воспроизводит валентные углы, равные 180°, но межъядерные расстояния в молекуле отражаются приблизительно. Пустоты между шариками не создают представления о заполнении пространства атомов электронной плотностью. Недостаток устранен в моделях Дрейдинга, обозначающих ядра атомов не шариками, а точками присоединения стержней друг к другу. Современные объемные модели дают более яркое представление об атомных и молекулярных орбиталях.
Гибридные атомные орбитали ацетилена
Углерод в возбужденном состоянии содержит три р-орбитали и одну s с неспаренными электронами. При образовании метана (СН4) они принимают участие в создании равноценных связей с атомами водорода. Известный американский исследователь Л. Полинг разработал учение о гибридном состоянии атомных орбиталей (АО). Объяснение поведения углерода в химических реакциях заключается в выравнивании АО по форме и энергии, образовании новых облаков. Гибридные орбитали дают более прочные связи, становится устойчивее формула.
Атомы углерода в молекуле ацетилена, в отличие от метана, подвергаются sp-гибридизации. По форме и энергии смешиваются s- и р электроны. Появляются две sp-орбитали, лежащие под углом 180°, направленные по разные стороны от ядра.
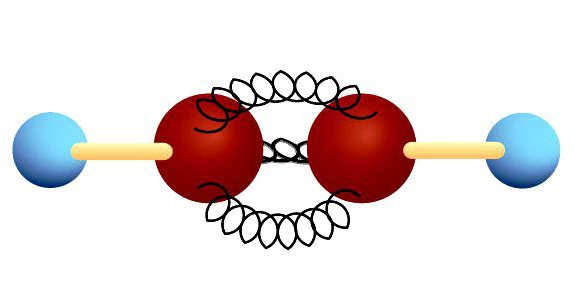
Тройная связь
В ацетилене гибридные электронные облака углерода участвуют в создании σ-связей с такими же соседними атомами и с водородом в парах С—Н. Остаются две перпендикулярные друг другу негибридные p-орбитали. В молекуле этина они участвуют в образовании двух π-связей. Вместе с σ возникает тройная связь, которую отражает структурная формула. Ацетилен отличается от этана и этилена расстоянием между атомами. Тройная связь короче двойной, но обладает большим запасом энергии, является более прочной. Максимальная плотность σ- и π-связей расположена в перпендикулярных областях, что приводит к образованию цилиндрического электронного облака.
Особенности химической связи в ацетилене
Молекула этина имеет линейную форму, что удачно отражает химическая формула ацетилена — H—C≡C—H. Атомы углерода и водорода находятся вдоль одной прямой, между ними возникают 3 σ- и 2 π-связи. Свободное движение, вращение вдоль оси C—C невозможно, этому препятствует наличие кратных связей. Другие особенности тройной связи:
- количество пар электронов, связывающих два атома углерода, — 3;
- длина — 0,120 нм;
- энергия разрыва — 836 кДж/моль.
Для сравнения: в молекулах этана и этилена длина одинарной и двойной химической связи — 1,54 и 1,34 нм соответственно, энергия разрыва С—С составляет 348 кДж/моль, C=C — 614 кДж/моль.
Гомологи ацетилена
Ацетилен — простейший представитель алкинов, в молекулах которых также присутствует тройная связь. Пропин СН3С≡СН — гомолог ацетилена. Формула третьего представителя алкинов — бутина-1 — СН3СН2С≡СН. Ацетилен — тривиальное название этина. Систематическая номенклатура алкинов подчиняется правилам ИЮПАК:
- в линейных молекулах указывается название основной цепи, возникшее от греческого числительного, к которому добавляется суффикс -ин и номер атома при тройной связи, например, этин, пропин, бутин-1;
- нумерацию главной цепочки атомов начинают с конца молекулы, ближайшего к тройной связи;
- для разветвленных углеводородов сначала идет наименование бокового ответвления, затем следует название главной цепочки атомов с суффиксом -ин.
- заключительная часть наименования — цифра, указывающая расположение в молекуле тройной связи, например, бутин-2.
Изомерия алкинов. Зависимость свойств от строения
Этин и пропин не имеют изомеров положения тройной связи, они появляются, начиная с бутина. Изомеры углеродного скелета есть у пентина и следующих за ним гомологов. Относительно тройной связи не проявляется пространственная изомерия ацетиленовых углеводородов.
Первые 4 гомолога этина — газы, плохо растворимые в воде. Ацетиленовые углеводороды C5 – C15 — жидкости. Твердыми веществами являются гомологи этина, начиная с углеводорода C17. Химическая природа алкинов испытывает значительное влияние тройной связи. Углеводороды этого типа активнее, чем этиленовые, присоединяют различные частицы. На этом свойстве основано широкое применение этина в промышленности и технике. При горении ацетилена выделяется большое количество теплоты, что находит применение в газовой резке и сварке металлов.


























