Более 10 миллионов органических и более 500 тысяч неорганических соединений известно химикам на сегодняшний день. Среди них есть сложные по строению и свойствам, которые применяются только в химических или медицинских целях. А есть те, что совсем не сложно устроены и очень распространены в быту. Но от этого не менее важны и значимы. К одному из таких веществ относится поваренная соль. В быту ее называют еще пищевой, а в химической промышленности именуют хлоридом натрия или хлористым натрием. В технологической промышленности ее называют минералом, который она образует в природе, - галитом, а также каменной солью или твердой каменной солью. Рассмотрим подробнее агрегатное состояние поваренной соли, строение, свойства, добычу, применение и историю введения в массовое потребление.

В каких состояниях существует поваренная соль?
Что такое агрегатное состояние веществ и каким оно бывает? Это зависит от того, о каком веществе идет речь. Каждый ученик старше 7 класса может назвать агрегатное состояние поваренной соли, потому что это то вещество, которое находится у каждого дома. Сегодня без него сложно современному человеку представить свою жизнь. К тому же агрегатное состояние поваренной соли совершенно очевидно невооруженным глазом - мелко или крупно дисперсные кристаллики правильной кубической формы. Однако, растворив соль в воде, мы получим ее уже в другом агрегатном состоянии - жидком. То же самое мы получим, если просто расплавим кристаллы при высокой температуре. Единственное состояние, которое для соли не характерно, - это газообразное. Но при определенных условиях можно получить и его.
Условия для изменения агрегатного состояния
- Чтобы получить соль в жидком состоянии путем плавки твердых кристаллов естественного происхождения, необходимо применить температуру, равную 800оС.
- Для перевода соли в газообразное состояние расплавленные кристаллы нужно довести до кипения (примерно 1400оС) и кипятить до полного перехода структурных компонентов в ионы (Na+ и CL-).
- Твердое агрегатное состояние поваренной соли - это ее естественный вид в природных условиях.

Почему происходит такой разброс температур при манипуляциях с кристаллами? Объясняется это строением кристаллической решетки.
Кристаллическая решетка
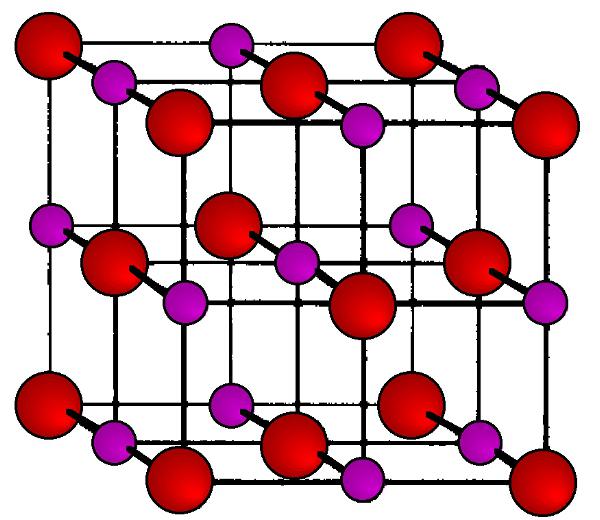
Она представляет собой правильные гранецентрированные кубические прозрачные кристаллы. В каждом углу куба (узлах кристаллической решетки) находятся чередующиеся положительно заряженные ионы Na+ и отрицательно заряженные ионы CL-. Благодаря резко различающейся электроотрицательности этих атомов между ними возникает настолько сильное электростатическое притяжение, что для разрушения его необходимо приложить жесткие условия (высокую температуру, механическое воздействие). Такой тип кристаллической решетки носит название ионной, и он характерен для всех солей щелочных, щелочноземельных и переходных металлов.
Именно поэтому температура поваренной соли (как для плавления, так и для кипения) настолько высока. Однако можно получить кристаллы не только кубической формы, но и пирамидальной (восьми-, двенадцати- и двадцатигранной). Для этого необходимо просто регулировать температуру выпаривания соленого раствора определенным образом. В любом случае внутренняя полость кристаллов остается заполнена жидкостью, если речь идет о растворе соли в воде.
Химическая формула хлористого натрия проста и выражается элементным составом NaCL.
Физические свойства галита
Физические свойства хлорида натрия можно описать несколькими пунктами:
- Твердые кристаллы белого, розового, голубого, фиолетового, красного цвета. Окраска зависит от наличия примесей при добыче. Чистое вещество кристально белого цвета.
- Растворяется в воде в соотношении примерно 100/30 (в 100 г воды 30 г соли). Хорошая растворимость объясняется присутствием диполей воды, которые ассоциируют вокруг себя ионы натрия и хлора, вызывая разрушение электростатического притяжения между ними и, как следствие, разрушение кристаллической решетки.
- Плавится и закипает при высоких температурах (800-1400оС).
- Имеет едва уловимый приятный запах.
- Соленый на вкус.

Химические свойства хлористого натрия
Как и любая растворимая средняя соль, хлористый натрий способен вступать во взаимодействия с:
- Другими солями по реакции обмена (обязательное условие: реакции выделения газа, выпадения осадка или образования малодиссоциируемого вещества): NaCL + AgNO3 = NaNO3 + AgCL (белый творожистый осадок). Это качественная реакция на ион CL-.
- С металлами, стоящими в ЭХРНМ левее натрия: К + NaCL = KCL + Na.
- Диссоциирует в водном растворе на свободные гидратированные диполями воды ионы: NaCL (водный р-р) = Na+ + CL-. В результате образуется раствор поваренной соли, который является сильным электролитом.
- Гидролизу не подвергается, так как является солью, образованной сильной кислотой и сильным основанием.
- При электролизе (действие электрического тока) разлагается с образованием свободных продуктов и едкого натра (каустика): NaCL = Na + Cl2 + NaOH.
Где в природе содержится хлорид натрия?
В настоящее время поваренная соль - вещество, часто встречаемое в природе. И хотя так было всегда, но в древние времена и времена средневековья она считалась очень дорогим продуктом. Все это от того, что не знали способов добычи соли из природных источников. А таких источников в мировых запасах очень много - галит считается почти неограниченным природным ресурсом. Где же соль находится в природе?
- Моря и океаны с соленой водой.
- Соленые озера.
- Соленые источники.
- Подземные воды.
- Воды лиманов.

Добыча галита
Извлечение и переработка соли имеют свою технологию, поскольку просто добытое вещество чаще всего к употреблению непригодно из-за высокого содержания посторонних примесей. Добывают галит по-разному, например:
- путем подземных работ;
- из пластов на дне соляных водоемов;
- выпариванием или вымораживаем соленой морской или океанской воды;
- выпариванием подземных вод.
Любой из способов дает возможность получить кристаллы галита. Однако для употребления в пищу они должны пройти еще один вид обработки - измельчение. Ведь вряд ли кто-то использует дома при приготовлении пищи крупный кристалл поваренной соли. Чаще всего ее приобретают в уже очищенном от примесей, измельченном практически в порошок виде. Также существуют виды соли йодированной, фторированной и так далее не только для пищевых, но и технических целей.
Применение каменной соли
Области применения и использования хлорида натрия весьма обширны. Основные из них вместе с примерами и результатами приведены в таблице.
| Отрасль промышленности | Основа использования соли | Результат |
| Ландшафтное строительство | Смягчение грунта при низких температурах и устранение утечки воды | Построение оросительных каналов и водоемов |
| Медицина | Сходство раствора соли с кровью человека. Кровезаменяющий раствор хлорида натрия (0,85%), называемый физиологическим | Восстановление кровяного баланса после обширных кровепотерь, нормализация работы натрие-калиевого насоса в сердечно-сосудистой системе, поддержание постоянства состава желудочного сока |
| Химическая | Синтезы практически значимых веществ на основе сырья хлористого натрия | Получают: гидрокарбонат натрия, соляную кислоту, металлический натрий, хлор, гидроксид натрия, стекло, пластмассы, мыло, бумагу и другие продукты |
| Пищевая | Антисептическое и антибактериальное действие соли | Консервирование продуктов (мясо, рыба, овощи), улучшение вкусовых качеств пищи |
| Металлургическая | Физические и химические свойства соли | Получение алюминия, солевых батареек, фильтров |
| Кожевенная | Антисептическое и антибактериальное действие соли | Обработка меха и сыромятной кожи при дублении |
История появления в быту
Соль появилась на столах в каждом доме далеко не сразу. Когда-то она ценилась на вес золота, причем в самом прямом смысле. Еще в XVIII веке некоторые народы Африки обменивали горсть соли на горсть золотого песка. Чуть позже в Эфиопии брусочки соли были стандартной валютой. В Древнем Риме военным легионерам даже месячное жалованье выдавали этим веществом, что со временем привело к называнию их солдатами. Дети бедных африканских народов просто лизали каменные куски повареной соли как лакомство. В Голландии она использовалась для наказания преступников, для пытки. Провинившемуся вообще не давали соль, и человек за короткое время умирал.
Впервые выделять и потреблять в пищу это вещество люди научились еще в древности. Тогда было обнаружено, что соль содержится в растениях. Поэтому их сжигали, а золу использовали как приправу. Позже в Китае научились выпаривать соль из морской воды, и процесс развития методов ее получения начал продвигаться быстрее.

На Руси соль добывали из озер (самые знаменитые соленые озера России до сих пор - Эльтон и Баскунчак). Тогда промысловое значение вещества являлось очень редким явлением. Добывали его только немногие купцы, которые затем продавали втридорога. Позволить себе иметь соль могли только богатые и знаменитые люди. Со временем производство и добыча наладились. Стали использоваться разные способы добычи и обработки, и на сегодняшний день одно из самых распространенных бытовых веществ - поваренная соль. Химия этого соединения, свойства, применение в медицине и других отраслях стали известны примерно с XVI-XVII веков.
Изучение в школьном курсе
Изучение структуры и агрегатного состояния, а также химических свойств поваренной соли начинается со школьной скамьи, в рамках такой дисциплины, как химия (8 класс). Соли в школьном курсе исследуются во всем их многообразии в природе. Ученики получают представление о химической основе, эмпирических формулах, основных физических и химических свойствах. Для простоты и удобства запоминания формул и физических свойств на форзаце учебника обычно располагаются соли, таблица которых дает представление об их растворимости в воде. Там же можно найти информацию о растворимости кислот, щелочей и оснований.

Важной характеристикой солей является их плавкость, на основе которой также построена их добыча в природе. Учащимся легко сориентироваться при решении задач на плавкость соли. Таблица и графические изображения позволяют не только увидеть, легкоплавко вещество или тугоплавко, но и определить примерную температуру плавления и кипения. Обычно такие таблицы также располагаются в учебниках ("Химия", 8 класс). Соли должны изучаться в контексте таких наук, как биология и физика. Поэтому множество задач для учащихся построено именно на интеграции межпредметных связей.


























