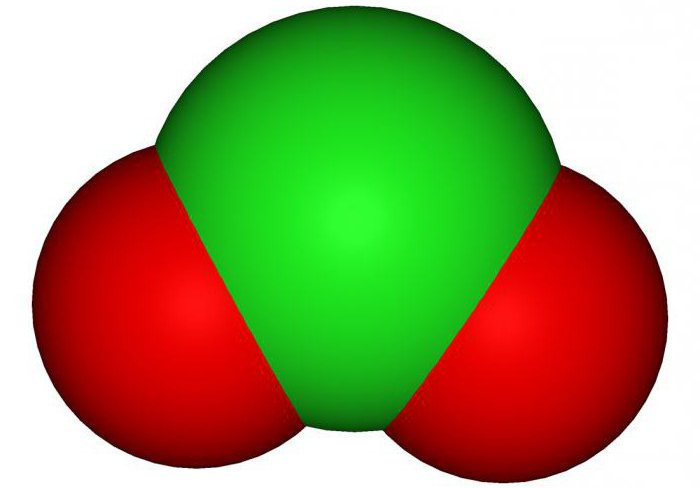
Диоксид хлора, или ClO2, — это неорганическое соединение химического элемента Cl (хлор) с химическим элементом O (кислород). В данной статье мы очень подробно рассмотрим данное вещество, а также выясним, где его применяют, как его получают в лабораториях и промышленности, как он действует на организм.
Что такое диоксид? Отличие диоксида от оксида
Многие ученики теряются при виде слова "диоксид", потому что в такой науке, как химия, это понятие уже немного устарело. Слово "диоксид" до сих пор можно встретить в учебниках, книгах и на просторах Интернета, но в некоторых школах уже перестали объяснять, что это такое.
Итак, все мы знаем, что такое оксид. Оксид — это соединение кислорода (O) с любым другим менее электроотрицательным химическим элементом. Оксидом является и ClO2. Диоксидом же принято называть соединение, в котором присутствует два атома O. Приставка "ди" в слове "диоксид" означает "два".
Если вы слышите слово "диоксид", значит в этом соединении два атома кислорода. Это поможет вам правильно записать химическую формулу соединения.
Физические свойства вещества
Диоксид хлора — это газообразное вещество, которое имеет характерный запах, а также окрас красно-желтого цвета. Но при температуре ниже 10 градусов по Цельсию вещество меняет свое агрегатное состояние и превращается в жидкость красно-коричневого цвета. При нагревании взрывается. Очень хорошо и быстро растворяется в воде. Очень хорошо смешивается и растворяется в некоторых органических растворителях, таких как уксусная и серная кислоты. Температура плавления вещества составляет -59 градусов по Цельсию, а его температура кипения — всего 9,7 градусов по Цельсию.
Получение лабораторным способом
На сегодняшний день пользуются лишь одним способом получения диоксида хлора в лаборатории — путем реакции хлората калия (KClO3) с щавелевой кислотой, которая имеет формулу H2C2O4. В результате данной реакции выделяется ClO2, а также вода и оксалат натрия.
Однако получить ClO2 можно и другим способом. Для этого существует специальная установка. Установка диоксида хлора — это полезная научная модель. Такая установка содержит в себе блок управления, реактор, насосы для передачи различных реагентов в реактор, а также различные вентили и клапаны. Для получения ClO2 используется серная кислота, растворы хлорида натрия и хлората натрия. В результате этого получается раствор диоксида хлора.

Получение промышленным способом
ClO2 ученые научились получать и промышленным способом. Для этого производят реакцию восстановления, в которой хлорат натрия восстанавливают диоксидом серы. В результате реакции выделяется диоксид хлора, получение которого мы добились, а также гидросульфат натрия.
Химические свойства вещества
У диоксида хлора есть несколько важных химических свойств. ClO2 является кислотным оксидом (он проявляет кислотные свойства, а также образует кислосодержащие кислоты). При растворении диоксида хлора в воде происходит реакция диспропорционирования, то есть образуются такие кислоты, как хлорноватая и хлористая. Если сам оксид хлора взрывается на свету, то его растворы вполне устойчивы в темноте, а на свету не взрываются, а очень медленно разлагаются.
ClO2 во многих реакциях ведет себя как оксилитель средней силы, реагирует с очень многими соединениями органической химии.
Применение
Диоксид хлора, применение которого довольно распространено по всему миру, сейчас наиболее популярен. Чаще всего данное вещество выступает отбеливателем. Оксид хлора используют, в частности, для отбеливания таких материалов, как бумага, мука и др.
Помимо этого, вещество ClO2 считается химиками одним из самых сильных антимикробных агентов во всем мире. Именно поэтому его очень часто используют для стерилизации, а также дезинфекции различных материалов. Он убивает болезнетворные микробы путем окисления, благодаря тому, что является средним окислителем. Диоксид хлора, применение которого благодаря кислотному свойству увеличилось, сейчас является незаменимым веществом.
Это вещество незаменимо в промышленности именно потому, что существует достаточно мало веществ, которые дезинфицируют материалы экономично и экологически безопасно. Дезинфекция с использование ClO2 абсолютно безопасна для окружающей нас среды. По сей день используют газообразный, а также жидкий Cl для стерилизации и обеззараживания воды. Но в последнее время, в связи с экологическими проблемами, используют самый безопасный дезинфектор — диоксид хлора. В отличие от чистого вещества хлора, известный нам ClO2 не вступает в реакции хлорирования с другими веществами и химическими элементами.
Воду, дезинфицированную хлором, нельзя не только пить, но и использовать для промывания участков кожи. Зато диоксид хлора помог решить эту проблему: он вполне безопасен, поскольку не учавствует в реакции хлорирования.

Действие диоксида хлора на организм
Диоксид хлора, его действие на организм изучается учеными несколько десятков лет. Сейчас это химическое вещество активно используется в пищевой промышленности, в качестве добавки E926. К сожалению, многие добавки E являются очень вредными, а обычным людям, потребителям продукции, мало что про них известно. Некоторые добавки, правда, безвредны, но есть особенно опасные. Диоксид хлора можно поставить посерединке: он вреден для организма человека, нежелателен, но при этом данное химическое вещество не оказывает сильных побочных действий на организм человека, в отличие от популярного сегодня глутамата натрия.
При употреблении пищи с содержанием этой добавки может появиться кашель, иногда довольно сильный и продолжительный, раздражение слизистых оболочек, астматические приступы. При попадании данного вещества в дыхательные пути может произойти раздражение легких.

Диоксид хлора — это довольно интересное вещество, которое ученые изучают уже на протяжении многих столетий. Оно незаменимо в промышленности, особенно в пищевой, является экологически безвредным и безопасным (конечно же, только при правильном использовании).




























