В каждой живой клетке происходит множество химических реакций. Ферменты (энзимы) – белки с особыми и крайне важными функциями. Их называют биокатализаторами. Основная функция белков-ферментов в организме заключается в ускорении биохимических реакций. Исходные реагенты, взаимодействие которых катализируется этими молекулами, именуются субстратами, а конечные соединения – продуктами.
В природе белки-ферменты работают только в живых системах. Но в современной биотехнологии, клинической диагностике, фармацевтике и медицине применяются очищенные энзимы или их комплексы, а также дополнительные компоненты, необходимые для работы системы и визуализации данных для исследователя.
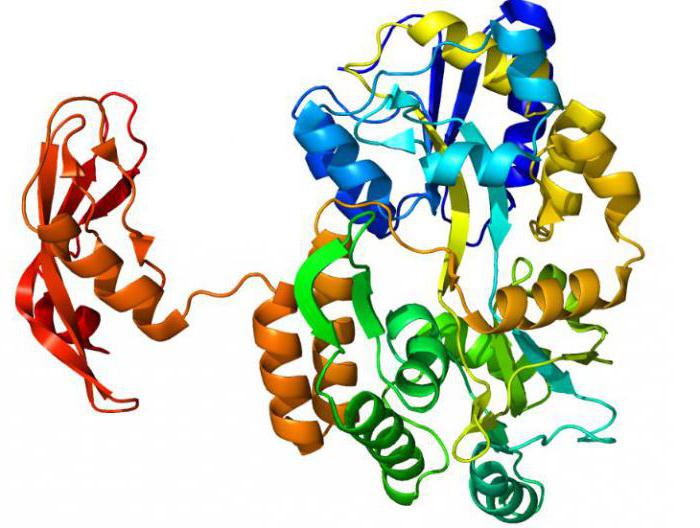
Биологическое значение и свойства ферментов
Без этих молекул живой организм не смог бы функционировать. Все процессы жизнедеятельности слажено работают благодаря энзимам. Главная функция белков-ферментов в организме – регулирование обмена веществ. Без них невозможен нормальный метаболизм. Регуляция активности молекул происходит под действием активаторов (индукторов) или ингибиторов. Контроль действует на разных уровнях синтеза белков. Он также «работает» в отношении уже готовой молекулы.
Основное свойства белков-ферментов – специфичность к определенному субстрату. И, соответственно, способность катализировать только одну или реже ряд реакций. Обычно подобные процессы обратимы. За выполнение обоих функций ответственен один фермент. Но это еще не все.
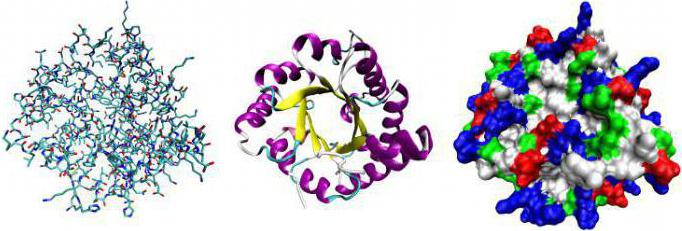
Роль белков-ферментов существенна. Без них не протекают биохимические реакции. За счет действия ферментов появляется возможность реагентам преодолеть активационный барьер без существенных затрат энергии. В организме нет возможности нагреть температуру более 100 °С или использовать агрессивные компоненты наподобие химической лаборатории. Белок-фермент соединяется с субстратом. В связанном состоянии происходит модификация с последующим освобождением последнего. Именно так действуют все катализаторы, применяемые в химическом синтезе.
Какие уровни организации молекулы белка-фермента?
Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение.
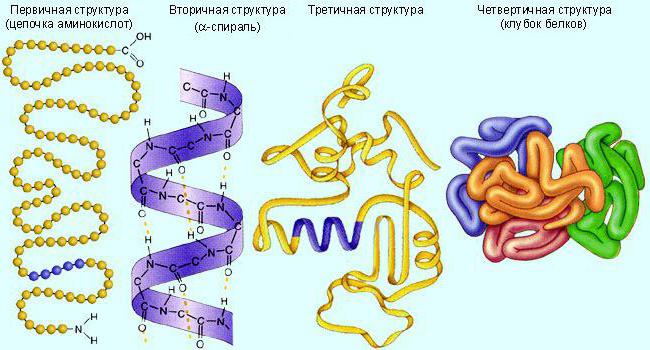
Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Дополнительные свойства ферментов
Среди них выделяют следующие особенности компонентов:
- Стереоспецифичность – образование только одного продукта.
- Региоселективность – разрыв химической связи или модификация группы только в одном положении.
- Хемоселективность – катализ только одной реакции.
Особенности работы
Уровень специфичности ферментов варьируется. Но любой энзим всегда активен в отношении конкретного субстрата или группы соединений, аналогичных по структуре. Небелковые катализаторы не обладают таким свойством. Специфичность измеряется константой связывания (моль/л), которая может достигать 10−10 моль/л. Работа активного фермента стремительна. Одна молекула катализирует тысячи-миллионы операций в секунду. Степень ускорения биохимических реакций существенно (в 1000-100000 раз) выше, чем у обычных катализаторов.
Действие ферментов построено на нескольких механизмах. Наиболее простое взаимодействие происходит с одной молекулой субстрата с последующим образованием продукта. Большинство энзимов способны связывать 2-3 разные молекулы, вступающие в реакцию. Например, перенос группы или атома от одного соединения к другому или двойное замещение по принципу «пинг-понг». В данных реакциях обычно соединяется один субстрат, а второй связывается посредством функциональной группы с ферментом.
Изучение механизма действия фермента происходит с помощью методов:
- Определения промежуточных и конечных продуктов.
- Изучения геометрии структуры и функциональных групп, связываемых с субстратом и обеспечивающих высокую скорость реакции.
- Мутации генов фермента и определения изменения в его синтезе и активности.
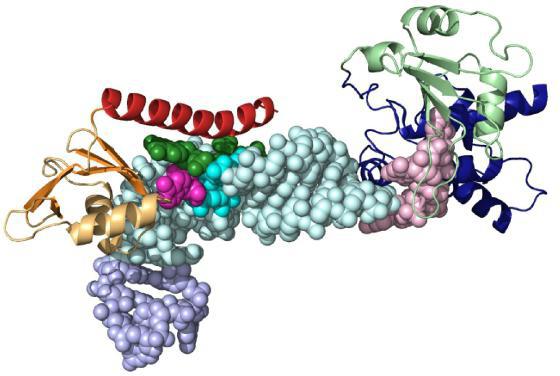
Активный и связывающий центр
Молекула субстрата значительно меньше по размеру, чем белок-фермент. Поэтому связывание происходит за счет небольшого числа функциональных групп биокатализатора. Они формируют активный центр, состоящий из определенного набора аминокислот. В сложных белках в структуре присутствует простетическая группа небелковой природы, которая также может входить в состав активного центра.
Следует выделить отдельную группу энзимов. У них в состав молекулы входит кофермент, постоянно связывающийся с молекулой и освобождающийся от нее. Полностью сформированный белок-фермент называется холоферментом, а при удалении кофактора – апоферментом. В качестве коферментов часто выступают витамины, металлы, производные азотистых оснований (НАД – никотинамидадениндинуклеотид, ФАД – флавинадениндинуклеотид, ФМН – флавинмононуклеотид).
Связывающий центр обеспечивает специфичность сродства к субстрату. За счет него формируется устойчивый субстратно-ферментный комплекс. Структура глобулы построена так, чтобы иметь на поверхности нишу (щель или впадину) определенного размера, обеспечивающего связывание субстрата. Располагается эта зона обычно недалеко от активного центра. У отдельных ферментов есть участки для соединения с кофакторами или ионами металлов.
Заключение
Белок-фермент играет важную роль в организме. Подобные вещества катализируют химические реакции, отвечают за процесс обмена веществ - метаболизм. В любой живой клетке постоянно происходит сотни биохимических процессов, включающих восстановительные реакции, расщепление и синтез соединений. Постоянно происходит окисление веществ с большим выделением энергии. Она в свою очередь тратится на формирование углеводов, белков, жиров и их комплексов. Продукты расщепления являются структурными элементами для синтеза необходимых органических соединений.



























