Являясь единицей живой материи, функционирующей как комплекс открытых биосистем, клетка постоянно обменивается с внешней средой веществами и энергией. Для поддержания гомеостаза в ней существует группа особых веществ белковой природы – энзимов. Строение, функции, а также регуляция активности ферментов изучаются специальной отраслью биохимии, называемой энзимологией. В данной статье на конкретных примерах мы рассмотрим различные механизмы и способы регуляции активности ферментов, присущие высшим млекопитающим и человеку.
Условия, необходимые для оптимальной активности энзимов
Биологически активные вещества, избирательно влияющие как на реакции ассимиляции, так и на расщепление, проявляют свои каталитические свойства в клетках при определенных условиях. Например, важно выяснить, в каком участке клетки протекает химический процесс, в котором участвуют энзимы. Благодаря компартментации (разделению цитоплазмы на участки) антагонистические реакции происходят в различных её частях и органоидах.
Так, синтез белков осуществляется в рибосомах, а их расщепление - в гиалоплазме. Клеточная регуляция активности ферментов, катализирующих противоположные биохимические реакции, обеспечивает не только оптимальную скорость протекания обмена веществ, но и препятствует формированию энергетически бесполезных метаболических путей.
Мультиферментный комплекс
Структурно-функциональная организация энзимов образует ферментативный аппарат клетки. Большинство химических реакций, протекающих в ней, взаимосвязаны. Если в многостадийном химическом процессе продукт первой реакции является реагентом для последующей, в этом случае пространственное расположение энзимов в клетке выражено особенно сильно.
Нужно помнить, что ферменты являются по своей природе простыми или сложными белками. И их чувствительность к клеточному субстрату объясняется прежде всего изменением собственной пространственной конфигурации третичной или четвертичной структуры пептида. Энзимы реагируют и на изменения не только внутри клеточных параметров, таких как химический состав гиалоплазмы, концентрацию реагентов и продуктов реакции, температуру, но и на изменения, происходящие в соседних клетках или в межклеточной жидкости.
Почему клетка разделена на компартменты
Разумность и логичность устройства живой природы просто поразительна. Это в полной мере относится и к жизненным проявлениям, характерным для клетки. Для ученого-химика совершенно понятно, что разнонаправленные ферментативные химические реакции, например синтез глюкозы и гликолиз, не могут протекать в одной и той же пробирке. Как же тогда происходят противоположные реакции в гиалоплазме одной клетки, являющейся субстратом для их проведения? Оказывается, клеточное содержимое – цитозоль, – в котором осуществляются антагонистические химические процессы, пространственно разделено и образует изолированные локусы – компартменты. Благодаря им метаболические реакции высших млекопитающих и человека регулируются особенно точно, а продукты обмена превращаются в формы, свободно проникающие через перегородки клеточных участков. Далее они восстанавливают свою первоначальную структуру. Кроме цитозоля, ферменты содержатся в органеллах: рибосомах, митохондриях, ядре, лизосомах.
Роль энзимов в энергетическом обмене
Рассмотрим окислительное декарбоксилирование пирувата. Регуляция каталитической активности ферментов в нем хорошо изучена энзимологией. Данный биохимический процесс протекает в митохондриях – двумембранных органеллах эукариотических клеток – и является промежуточным процессом между бескислородным расщеплением глюкозы и циклом Кребса. Пируватдегидрогеназный комплекс – PDH – содержит три фермента. У высших млекопитающих и человека снижение его происходит при повышении концентрации Ацетил-КоА и NATH, то есть в случае появления альтернативных возможностей образования молекул Ацетил-КоА . Если же клетка нуждается в дополнительной порции энергии и требует новых молекул акцептора для усиления реакций цикла трикарбоновых кислот, то ферменты активируются.

Что такое аллостерическое ингибирование
Регуляция активности ферментов может осуществляться специальными веществами – каталитическими ингибиторами. Они могут ковалентно связываться с определенными локусами энзима, минуя его активный центр. Это приводит к деформации пространственной структуры катализатора и автоматически влечет за собой снижение его ферментативных свойств. Иными словами, происходит аллостерическая регуляция активности ферментов. Добавим также, что такая форма каталитического воздействия присуща олигомерным энзимам, то есть тем, чьи молекулы состоят из двух и более полимерных белковых субъединиц. Рассмотренный в предыдущем заголовке PDH-комплекс как раз и содержит три олигомерных фермента: пируват дегидрогеназу, дегидролипоил дегидрогеназу и гидролипоил трансацетилазу.
Регуляторные ферменты
Исследования в энзимологии установили тот факт, что скорость химических реакций зависит как от концентрации, так и от активности катализатора. Чаще всего метаболические пути содержат главные ферменты, регулирующие скорость реакций на всех его участках.
Они называются регуляторными и обычно воздействуют на начальные реакции комплекса, а также могут участвовать в наиболее медленно протекающих химических процессах в необратимых реакциях, или же присоединятся к реагентам в точках ветвления метаболического пути.
Как осуществляется пептидное взаимодействие
Одним из способов, с помощью которого происходят регуляция активности ферментов в клетке, является белок-белковое взаимодействие. О чем речь? Осуществляется присоединение регуляторных белков к молекуле энзимов, вследствие чего происходит их активация. Например, фермент аденилатциклаза находится на внутренней поверхности клеточной мембраны и может взаимодействовать с такими структурами, как рецептор гормона, а также с пептидом, расположенным между ним и ферментом. Так как в результате соединения гормона и рецептора промежуточный белок изменяет свою пространственную конфирмацию, этот способ усиления каталитических свойств аденилатциклазы в биохимии носит название «активации вследствие присоединения белков-регуляторов».
Протомеры и их роль в биохимии
Эта группа веществ, иначе называемая протеинкиназами, ускорят перенос аниона PO43- на гидроксогруппы аминокислот, входящих в пептидную макромолекулу. Регуляция активности ферментов протомеров будет рассмотрена нами на примере протеинкиназы А. Её молекула – тетрамер, состоит из двух каталитических и двух регуляторных пептидных субъединиц и не функционирует как катализатор до тех пор, пока к регуляторным участкам протомера не прикрепятся четыре молекулы цАМФ. Это вызывает трансформацию пространственной структуры белков-регуляторов, что приводит к высвобождению двух активированных каталитических белковых частиц, то есть происходит диссоциация протомеров. Если же от регуляторных субъединиц отделяются молекулы цАМФ, то неактивный комплекс протеинкиназы снова восстанавливается до тетрамера, так как происходит ассоциация каталитических и регуляторных пептидных частиц. Таким образом, рассмотренные выше пути регуляции активности ферментов обеспечивают их обратимый характер.
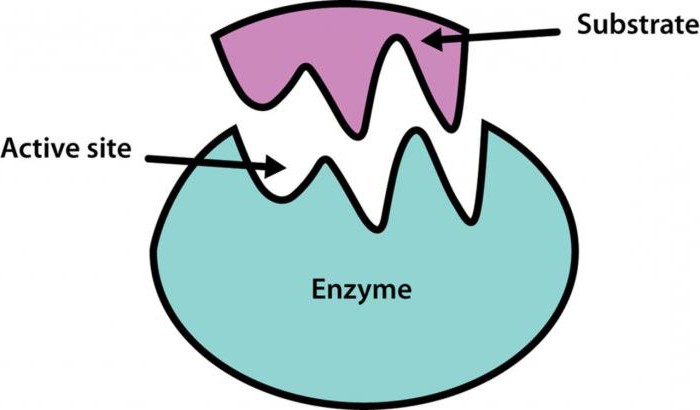
Химическая регуляция активности ферментов
Биохимия изучила и такие механизмы регуляции активности ферментов, как фосфорилирование, дефосфорилирование. Механизм регуляции активности ферментов в данном случае имеет следующий вид: аминокислотные остатки энзима, содержащие группы ОН-, изменяют свою химическую модификацию вследствие воздействия на них фосфопротеинфосфатаз. В этом случае коррекции поддается активный центр фермента, причем для одних энзимов это является причиной, активирующей их, а для других - ингибирующей. В свою очередь каталитические свойства самих фосфопротеинфосфатаз регулируются гормоном. Например, животный крахмал – гликоген – и жир в промежутках между приемами пищи расщепляются в желудочно-кишечном тракте, точнее, в двенадцатиперстной кишке под воздействием глюкагона – панкреатического фермента.
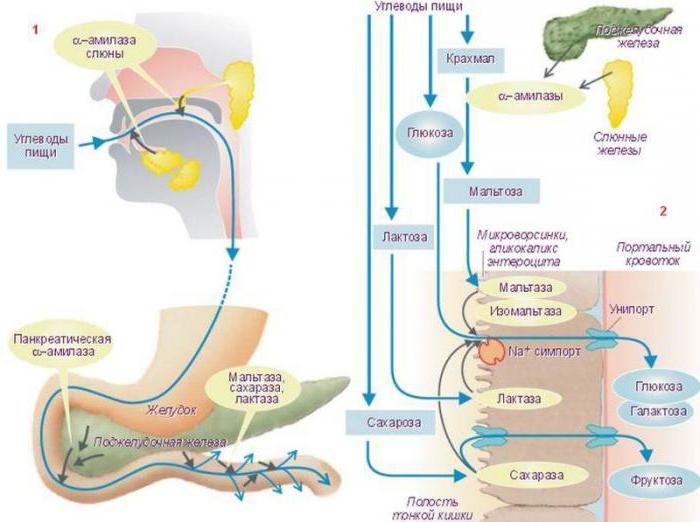
Этот процесс усиливается благодаря фосфорилированию трофических энзимов ЖКТ. В период активного пищеварения, когда пища поступает из желудка в двенадцатиперстную кишку, синтез глюкагона усиливается. Инсулин – еще один фермент поджелудочной железы, вырабатываемый альфа-клетками островков Лангерганса, – взаимодействует с рецептором, включая механизм фосфорилирования тех же пищеварительных энзимов.
Частичный протеолиз
Как видим, уровни регуляции активности ферментов в клетке разнообразны. Для энзимов, находящихся вне цитозоля или органоидов (в плазме крови или в желудочно-кишечном тракте), способом их активации служит процесс гидролиза пептидных связей CO-NH. Он необходим, так как такие ферменты синтезируются в неактивной форме. От молекулы энзима отщепляется пептидная часть, а в оставшейся структуре модификации подвергается активный центр. Это приводит к тому, что фермент «входит в рабочее состояние», то есть становится способным влиять на протекание химического процесса. Например, неактивный фермент поджелудочной железы трипсиноген не расщепляет белки пищи, поступающие в двенадцатиперстную кишку. В ней под действием энтеропептидазы происходит протеолиз. После чего энзим активируется и называется теперь трипсином. Частичный протеолиз – процесс обратимый. Он происходит в таких случаях, как активация энзимов, расщепляющих полипептиды, в процессах свертывания крови.
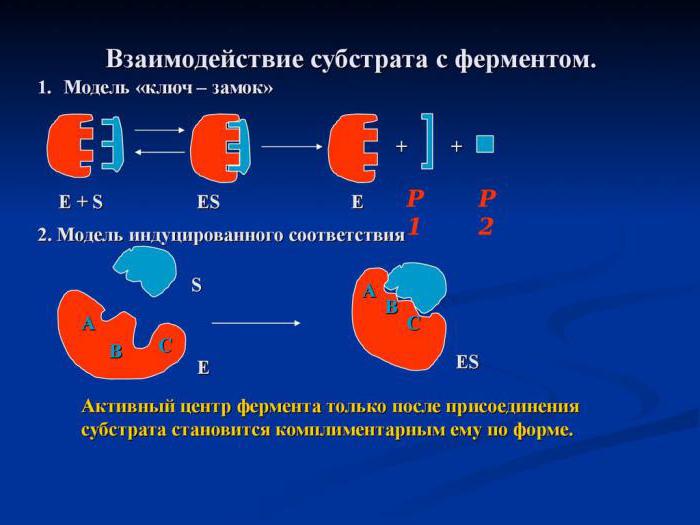
Роль концентрации исходных веществ в метаболизме клетки
Регуляция активности фермента доступностью субстрата частично рассматривалась нами в подзаголовке «Мультиферментный комплекс». Скорость протекания каталитических реакций, проходящих в несколько стадий, сильно зависит от того, сколько молекул исходного вещества находится в гиалоплазме или органеллах клетки. Это связано с тем, что скорость метаболического пути прямо пропорциональна концентрации исходного вещества. Чем больше молекул реагента находится в цитозоле, тем выше скорость всех последующих химических реакций.
Аллостерическая регуляция
Ферментам, активность которых контролируется не только концентрацией исходных веществ-реагентов, но еще и веществами-эффекторами, присуща так называемая аллостерическая регуляция. Чаще всего такие энзимы представлены промежуточными продуктами обмена веществ в клетке. Благодаря эффекторам и осуществляется регуляция активности ферментов. Биохимия доказала, что такие соединения, названные аллостерическими энзимами, очень важны для метаболизма клетки, так как обладают чрезвычайно высокой чувствительностью к изменениям её гомеостаза. Если энзим угнетает химическую реакцию, то есть снижает её скорость – его называют отрицательным эффектором (ингибитором). В противоположном случае, когда наблюдается увеличение скорости реакции, речь идет об активаторе – положительном эффекторе. В большинстве случаев исходные вещества, то есть реагенты, вступающие в химические взаимодействия, играют роль активаторов. Конечные же, продукты, образовавшиеся в результате многостадийных реакций, ведут себя как ингибиторы. Такой вид регуляции, построенной на взаимосвязи концентрации реагентов и продуктов, называется гетеротрофным.




























