В этой статье мы рассмотрим получение сероводорода из серы. Подробнее разберем физические и химические свойства данного вещества.

Строение
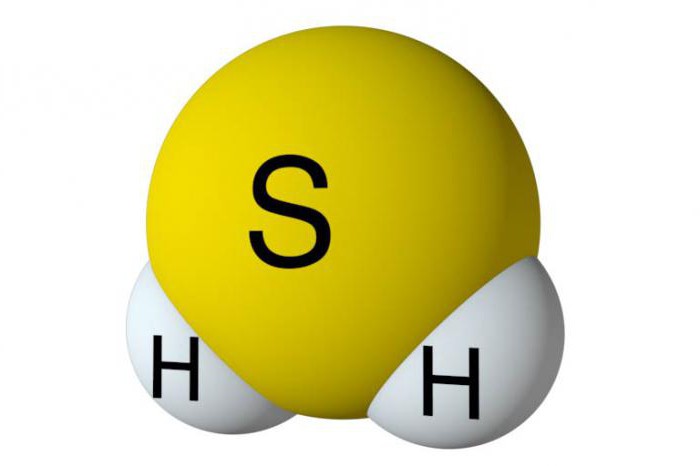
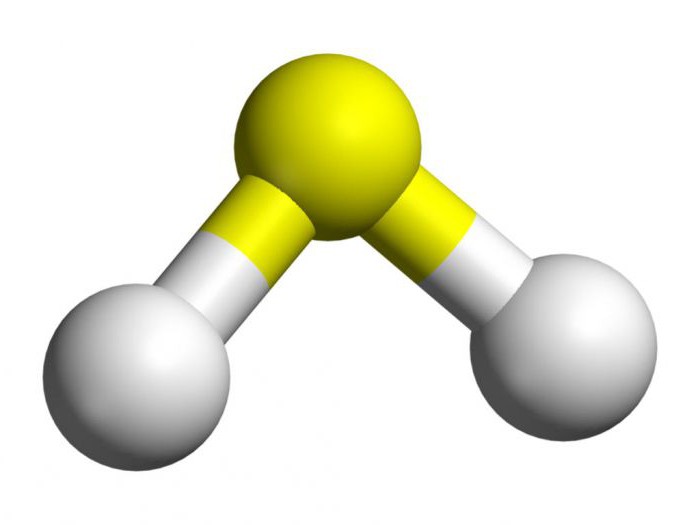
Для того чтобы проанализировать основное получение сероводорода, необходимо выяснить особенности его строения. В составе данного вещества содержатся один атом серы и два водорода. Они являются неметаллами, поэтому между элементами образуются ковалентные полярные связи. В сероводороде угловое строение. Между серой и водородом образуется угол в 92 градуса, что чуть меньше, чем в воде.
Физические свойства
Запах сероводорода, напоминающий тухлые яйца, знаком всем. При нормальных условиях данное вещество находится в газообразном состоянии. Оно не имеет цвета, плохо растворимо в воде, ядовито. В среднем при 20 градусах по Цельсию в воде будет растворяться 2,4 объема сероводорода. У сероводородной воды выявлены незначительные кислотные свойства, диссоциация вещества протекает ступенчато. Ядовитый сероводород опасен даже в незначительных дозах. Содержание в воздухе около 0,1 процента сероводорода приводит к параличу дыхательного центра с потерей сознания. Например, легендарный естествоиспытатель Плиний Старший погиб в 79 веке до нашей эры именно от сероводорода, который образовывался при извержении Везувия.
Причина отравляющего действия сероводорода в его химическом взаимодействии с гемоглобином крови. Железо, содержащееся в этом белке, образует сульфид с сероводородом.
Предельно допустимой концентрацией в воздухе сероводорода считается 0,01 мг/л. В качестве противоядия используется вдыхание чистого кислорода либо воздуха, в составе которого есть незначительное количество хлора.
Работа с сероводородом предполагает соблюдение определенных правил безопасности. Все эксперименты, касающиеся данного газообразного вещества, осуществляются в герметичных приборах и вытяжных шкафах.

Способы получения сероводорода
Каково получение сероводорода в лаборатории? Самым распространенным вариантом является взаимодействие водорода с серой. Данная химическая реакция относится к соединению, проводится в вытяжном шкафу.
Кроме того, получение сероводорода возможно и при обмене между твердым сульфидом железа (2) и раствором серной либо соляной кислоты. Чтобы получить такой результат, в пробирку достаточно взять несколько кусков сульфида, не превышающих по размеру горошину. Далее в пробирку (до половины объема) добавляют раствор кислоты, закрывают газоотводной трубкой. Прибор помещают под вытяжку, пробирку нагревают. Химическое взаимодействие сопровождается выделением пузырьков газа. Такое получение сероводорода позволяет создавать количество вещества, достаточное для рассмотрения его химических свойств.
Какие еще бывают способы? В лаборатории допускается получение сероводорода путем взаимодействия металлического железа (под вытяжкой) с кристаллической серой, с последующим взаимодействием сульфида с серной кислотой.
Химические свойства
Сероводород взаимодействует с кислородом воздуха, горит он голубоватым цветом. В случае полного сгорания продуктами реакции являются оксид серы (4) и вода. Учитывая, что печной газ является кислотным оксидом, в растворе он образует слабую сернистую кислоту, окрашивающую синюю лакмусовую бумажку в красный цвет.
В случае недостаточного количества сероводорода образуется кристаллическая сера. Данный процесс считается промышленным способом получения из сероводорода чистой серы.
У данного химического вещества выявлены и отличные восстановительные способности. Они проявляются, к примеру, при взаимодействии с солями, галогенами. Для того чтобы провести в лабораторных условиях подобную реакцию, в пробирки с хлором и бромом наливают раствор сероводорода, наблюдают обесцвечивание. В качестве продукта реакции наблюдают образование кристаллической серы.
При химической реакции сероводорода с водой происходит образование катиона гидроксония Н3О+.
Сероводород способен образовывать два вида соединений: сульфиды (средние соли) и гидросульфиды (кислые соли).
У щелочных и щелочноземельных металлов сульфиды являются бесцветными соединениями. У тяжелых металлов (меди, никеля, свинца) они имеют черный цвет. Сульфид марганца обладает розовым цветом. Многие соли не растворяются в воде.
Качественной реакцией на сульфиды считают взаимодействие с раствором сульфата меди (2). Продуктом подобного взаимодействия будет выпадение черного осадка сульфида меди (2).
Заключение
В природе это вещество находится в минеральных источниках, вулканических газах. Данное соединение является продуктом гниения животных и растительных организмов, его отличает характерный запах сероводорода. Природные сульфиды обнаружены в составе редких металлов, в металлургии из них получают соответствующие элементы. Важно помнить и о том, что сероводород является сильным отравляющим веществом.