Воздействие различных химических веществ на организм человека неоднозначно. Большинство нам известных соединений или являются нейтральными, или играют положительную роль в жизнедеятельности человека. Но есть группа веществ, представляющих серьёзную угрозу для здоровья. Они разделены на несколько классов. Рассматриваемая в данной статье мышьяковая кислота – одно из таких токсичных химических соединений. Согласно принятой в настоящее время классификации, она входит во второй класс повышенной опасности, наряду с хлороформом, соединениями свинца и лития. Изучим свойства мышьяковой кислоты более подробно.
Строение молекулы и агрегатное состояние вещества
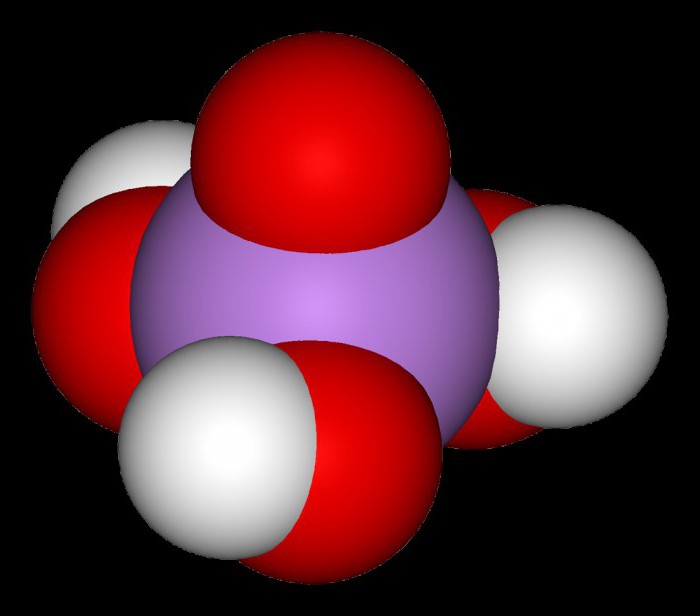
Это соединение при обычных условиях имеет кристаллическую структуру. Являясь трехосновной, мышьяковая кислота, формула которой H3AsO4, имеет как средние, так и кислые соли. Например, гидроарсенат калия – K2HAsO4, дигидроарсенат натрия – NaH2AsO4, арсенат лития – Li3AsO4. Прокаливая мышьяковую кислоту, получают гемипентоксид мышьяка, называемый мышьяковым ангидридом. Его белые прозрачные кристаллы образуют стекловидную массу, плохо растворяющуюся в воде.
Диссоциация
H3AsO4, наряду с муравьиной кислотой и гидроксидом свинца, является умеренно слабым электролитом. Так, в таблице ионизации важнейших кислот ортомышьяковая кислота имеет три константы диссоциации: 5,6 х 10-3, 1,5 х 10-7 и 3, 89 х 10-12. Эти показатели количественно характеризуют силу кислоты. В соответствии с константами диссоциации, в ряду неорганических кислот H3AsO4 занимает положение между хромовой и сурьмяной кислотами. Российские химики-экспериментаторы А. Л. и И. Л. Агафоновы сформулировали математическое выражение, в котором вывели зависимость первой и второй константы диссоциации мышьяковой кислоты от температуры в интервале от 0°С до 50°С.
Особенности химических свойств
Степень окисления атома мышьяка, входящего в состав молекулы кислоты, равна +5. Это говорит о том факте, что само соединение в химических реакциях с другими веществами проявляет окислительные свойства. Так, при её взаимодействии с иодидом калия, выступающим в качестве восстановителя, в кислой среде среди продуктов реакции мы обнаружим мышьяковистую кислоту H3AsO3. Напомним, что мышьяковая кислота, формула которой H3AsO4, является трехосновной, а значит, в реакциях со щелочами или нерастворимыми основаниями она может давать три вида солей: средние, гидро- и дигидроарсенаты. Качественной реакцией на ион AsO43- в аналитической химии служит взаимодействие самой мышьяковой кислоты или её солей с растворимыми солями серебра, например, с нитратом. В результате наблюдаем выпадение осадка Ag3AsO4 кофейного цвета.
Йодометрический метод определения мышьяковой кислоты
В аналитической химии важной задачей является обнаружение химических соединений в исследуемых растворах. Мышьяковая кислота, химические свойства которой мы рассматривали ранее, может быть выявлена микрометодом йодометрии. К 1 мл её раствора приливают такой же объем 4н. раствора соляной кислоты и 1 мл 4% раствора йодида калия. Образуется сесквиоксид мышьяка As2O3, масса которого при строгом соблюдении количественных объемов реагентов всегда одинакова и равна 0,5746 мг.

Окислительная способность мышьяковой кислоты
Как известно, H3AsO4, как и ортофосфорная кислота, является электролитом средней силы. Её белые прозрачные кристаллы расплываются на воздухе и имеют состав 2H3AsO4 х H2O. Её соли, образованные щелочными металлами (как средние, так и кислые), в водных растворах имеют рН больше 7. Арсенаты лития, калия, натрия и аммония хорошо растворимы в воде, а остальные средние соли в ней не растворяются. Мышьяковая кислота – хороший окислитель. В окислительно-восстановительных реакциях она восстанавливается до мышьяковистой кислоты или арсина.
H3AsO4 + 2e + 2H+ = H3AsO3 + H2O
H3AsO4 + 8e + 8H+ = AsH3 + 4H2O
Кроме того, мышьяковая кислота легко окисляет различные металлы, сульфитную и йодидную кислоты, а также сероводород.

Получение мышьяковой кислоты
В лабораторных условиях H3AsO4 может быть получена реакцией сесквиоксида мышьяка с нитратной кислотой при нагревании. В продуктах обнаруживается оксид трехвалентного азота и H3AsO4. Еще один способ получения – это растворение в воде оксида мышьяка. Часто для её получения применяют одновременное окисление и гидролиз триалкиларсенитов подогретым до 50° С раствором пероксида водорода. Одновременно из реакционной смеси отводят воду и спирт. Затем раствор упаривают и получают мышьяковую кислоту особой чистоты. В природе сырьем для получения мышьяковой кислоты служат минералы: арсенолит и арсенопирит, залежами которых богаты Челябинская и Читинская области Российской Федерации.
Применение H3AsO4
Учитывая тот факт, что ортомышьяковая кислота является одним из сильных ядов. Её применение в промышленности и быту ограничено. Более распространены соли – арсенаты, чья токсичность значительно меньше, чем у самой H3AsO4. Так, в деревообрабатывающей промышленности вместе с сернокислым цинком и натриевой солью пентахлорфенола, мышьяковую кислоту применяют для обработки древесины. Такой метод сводит к минимуму потери от разрушения целлюлозы грибковыми инфекциями и личинками жуков-древоточцев. В медицине H3AsO4 применяют в составе препарата «Атоксил» для лечения протозойных инфекций, таких как лямблиоз, балантидиаз, изоспороз.

Нужно отметить, что зараженность населения этими инфекциями в последнее время резко выросла. Причин несколько – например, заражение через продукты питания, содержащие споры простейших, через укусы насекомых или половым путем. Мышьяковая кислота используется в качестве исходного вещества в процессах производства оптических стекол, а также в электротехнике. Производное H3AsO4 - её натриевую соль, успешно применяют в дерматологии и фтизиатрии. Соединения мышьяка используются в стоматологии (мышьяковая паста) в качестве препарата, используемого для снижения болевой чувствительности воспаленного нерва при его удалении из зубного канала.
Действие кислоты на организм человека
Как уже было сказано ранее, H3AsO4 входит во второй класс повышенной опасности – высоко опасные вещества. Смертельной считается дозировка как самой кислоты, так и её солей в пределах от 15 до 150 мг на килограмм массы тела человека. Наряду с общим отравляющим эффектом, мышьяковая кислота вызывает некроз кожных покровов и слизистых оболочек внутренних органов: легких, желудка, кишечника.
В лаборатории при проведении опытов с арсенатами и H3AsO4 обязательно использование защитных перчаток, а сами эксперименты проводят под вытяжкой. В случае интоксикации на уровне клетки нарушается её ферментативная система, так как происходит инактивация энзимов. В организме человека отравление арсенатами приводит к парезам и даже параличам. В онкологии при проведении химиотерапии при несоблюдении режима дозирования препаратов регистрируются случаи отравления миарсенолом и новарсенолом. Первая помощь при отравлении солями мышьяковой кислоты заключается в немедленном промывании желудка (например, раствором унитиола или препаратами диоксида кремния).

Чтобы не допустить острой почечной недостаточности, назначают процедуру гемодиализа. В качестве антидота, кроме 5% раствора унитиола, можно использовать антидот Стрижевского. До приезда неотложной скорой помощи в домашних условиях для снижения уровня интоксикации можно применить раствор лимонной кислоты, затем вызвать рвоту и промыть желудок. Все лечебные мероприятия необходимо проводить с соблюдением строгого постельного режима под наблюдением врача.


























