Все мы слышали о ферментах, но вряд ли каждый из нас досконально знает, как именно устроены эти вещества и зачем они нужны. Эта статья поможет разобраться в структуре и функциях ферментов (энзимов) в целом и их активных центров в частности.
История исследований
В 1833 году французский химик Ансельм Пайен выявил и описал свойства фермента амилазы.
Несколько лет спустя Луи Пастер, изучая превращение сахара в спирт при участии дрожжей, предположил, что этот процесс происходит за счет химических веществ, входящих в состав дрожжей.
В конце XIX века Физиолог Вилли Кюне впервые ввел в употребление термин "энзим".
Немец Эдуард Бухнер в 1897 году выделил и описал зимазу - ферментативный комплекс, который катализирует реакцию превращения сахарозы в этиловый спирт. В природе зимаза в большом количестве содержится в дрожжах.
Точно неизвестно, когда и кто открыл активный центр фермента. Это открытие приписывают лауреату Нобелевской премии химику Эдаурду Бухнеру, американскому биологу Джеймсу Самнеру и другим известным ученым, работавшим над изучением ферментативного катализа.

Общие сведения о ферментах
Напомним, что ферменты - вещества белковой природы, которые выполняют в живых организмах функции катализаторов химических реакций. В ферменте есть участки, которые непосредственно не принимают в этом участия, протекание реакции обеспечивает активный центр фермента.
Приведем некоторые свойства ферментов:
1) Эффективность. Небольшого количества катализатора достаточно, чтобы ускорить химическую реакцию в 106 раз.

2) Специфичность. Один фермент не универсальный катализатор любой реакции в клетке. Для ферментов выражена специфичность действия: каждый фермент катализирует только одну или же несколько реакций с похожими субстратами (исходными реагентами), но для реагентов другой химической природы этот же фермент может быть бесполезен. Взаимодействие с подходящими субстратами и дальнейшее ускорение реакции обеспечивает активный центр фермента.
3) Переменная активность. Активность ферментов в клетке постоянно меняется от низкой до высокой.
4) Концентрация некоторых ферментов в клетке не постоянна и может изменяться в зависимости от внешних условий. Такие ферменты в биологии называют индуцибельными.
Классификация ферментов
По своей структуре ферменты принято делить на простые и сложные. Простые состоят исключительно из аминокислотных остатков, сложные имеют в составе вещества небелковую группу. Сложные называют коферментами.
По типу катализируемых реакций ферменты делятся на:
1) Оксидоредуктазы (катализируют окислительно-восстановительные реакции).
2) Трансферазы (переносят отдельные группы атомов).
3) Лиазы (расщепляют химические связи).
4) Липазы (образуют связи в реакциях за счет энергии АТФ).
5) Изомеразы (учувствуют в реакциях взаимного превращения изомеров).
6) Гидролазы (катализируют химические реакции с гидролитическим расщеплением связей).
Структура фермента
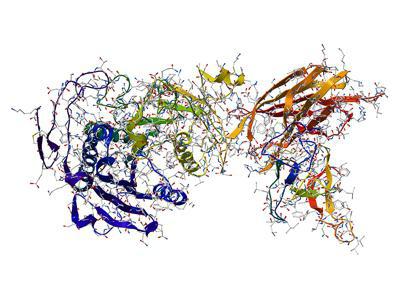
Фермент - сложная трехмерная структура, в состав которой входят в основном аминокислотные остатки. Также есть простетическая группа - компонент небелковой природы, связанный с аминокислотными остатками.
Ферменты - в основном глобулярные белки, которые могут объединяться в сложные комплексы. Как и другие вещества белковой природы, ферменты денатурируют при повышении температуры или под воздействием некоторых химических реактивов. Во время денатурации изменяется третичная структура фермента и, соответственно, свойства активного центра ферментов. В результате активность энзима резко уменьшается.
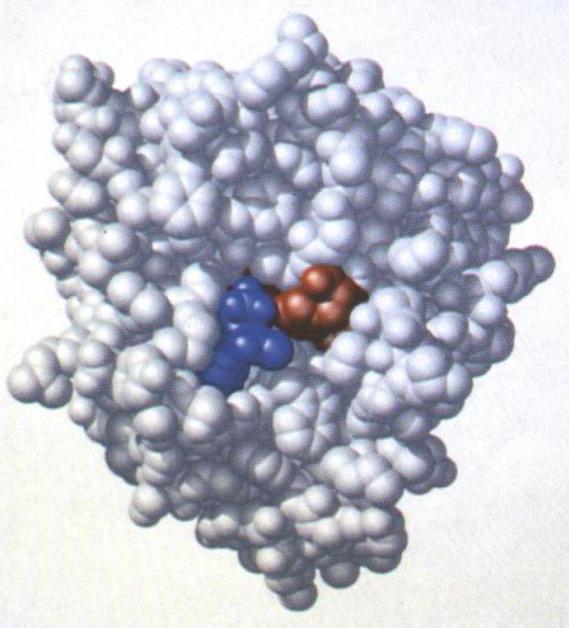
Катализируемый субстрат обычно значительно меньше самого фермента. Самый простой энзим состоит из шестидесяти аминокислотных остатков, а его активный центр - всего из двух.
Существуют ферменты, каталитический участок которых представлен не аминокислотами, а простетической группой органического или (чаще) неорганического происхождения - кофактором.
Понятие об активном центре
Лишь небольшой участок фермента принимает непосредственное участие в химических реакциях. Эта часть фермента и называется активным центром. Активный центр фермента - это липид, несколько аминокислотных остатков или простетическая группа, которая связывается с субстратом и катализирует реакцию. Аминокислотные остатки активного центра могут принадлежать любым аминокислотам - полярным, неполярным, заряженным, ароматическим, незаряженным.
Активный центр фермента (это липид, аминокислоты или другие вещества, способные взаимодействовать с реагентами) - самая важная часть фермента, без него эти вещества были бы бесполезны.
Обычно молекула фермента имеет только один активный центр, связывающийся с одним или несколькими схожими реагентами. Аминокислотные остатки активного центра формируют водородные, гидрофобные или ковалентные связи, образуя энзим-субстратный комплекс.
Структура активного центра
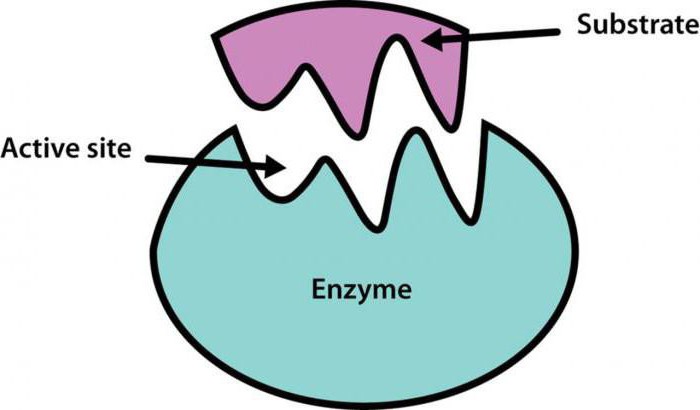
Активный центр простых и сложных ферментов представляет собой карман или щель. Эта структура активного центра фермента должна электростатически и геометрически соответствовать субстрату, так как изменение третичной структуры фермента может изменить активный центр.
Связывающий и каталитический центр - участки активного центра фермента. Очевидно, что связывающий центр "проверяет" субстрат на совместимость и связывается с ним, а каталитический центр принимает непосредственное участие в реакции.
Связывание активного центра с субстратом
Для того чтобы пояснить, как же активный центр фермента связывается с тем или иным реагентом, было предложено несколько теорий. Самая популярная из них - теория Фишера, она же теория "замка и ключа". Фишер предположил, что существует фермент, идеально подходящий каждому субстрату по своим физико-химическим свойствам. После образования энзим-субстратного комплекса никаких модификаций не происходит.
Другой американский ученый - Дэниел Кошланд - дополнил теорию Фишера предположением о том, что активный центр фермента может менять свою конформацию до тех пор, пока не подойдет определенному субстрату.
Кинетика ферментативных реакций
Особенности протекания ферментативных реакций изучает отдельная отрасль биохимии - ферментативная кинетика. Эта наука изучает особенности протекания реакций при различных концентрациях ферментов и субстратов, зависимость скорости реакции от температуры внутри клетки, а также свойства активного центра ферментов в зависимости от изменения физических и химических параметров среды.
Ферментативная кинетика оперирует такими понятиями, как скорость реакции, энергия активации, активационный барьер, молекулярная активность, удельная активность и др. Рассмотрим некоторые из этих понятий.
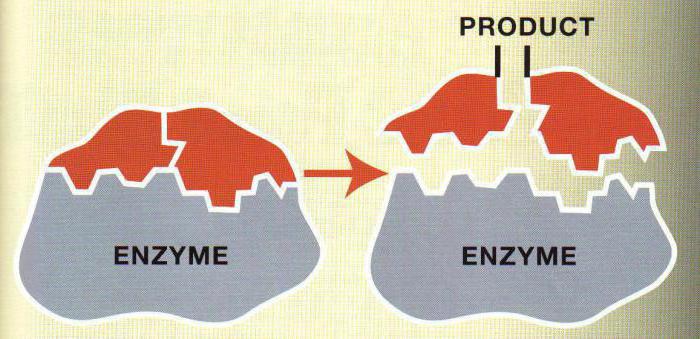
Чтобы произошла биологическая реакция, реагентам необходимо передать некоторую энергию. Эта энергия называется энергией активации.
Добавление фермента к реагентам позволяет снизить энергию активации. Некоторые вещества на реагируют без участия энзимов, так как энергия активации слишком высока. Равновесие реакции при добавлении фермента не сдвигается.
Скорость реакции - количество продукта реакции, появившееся или исчезнувшее в единицу времени.
Зависимость скорости реакции от концентрации субстрата характеризует безразмерная физическая величина - константа Михаэлиса.
Молекулярная активность - количество молекул субстрата, преобразованных одной молекулой фермента в единицу времени.



























центр простых и сложных ферментов?