Как выглядит электронная конфигурация калия? Для того чтобы ответить на этот вопрос, рассмотрим строение атома, а также правила распределения электронов по уровням и подуровням.
Квантовая механика
Электронная конфигурация калия описывается уравнением Шредингера. Оно связывает потенциальную энергию взаимодействия ядра и электронов, а также величину отталкивания между частицами, имеющими равный заряд. Квантовая механика пользуется постулатами данного уравнения, объясняя наличие у каждого энергетического уровня определенного энергетического запаса.
Многоэлектронные атомы
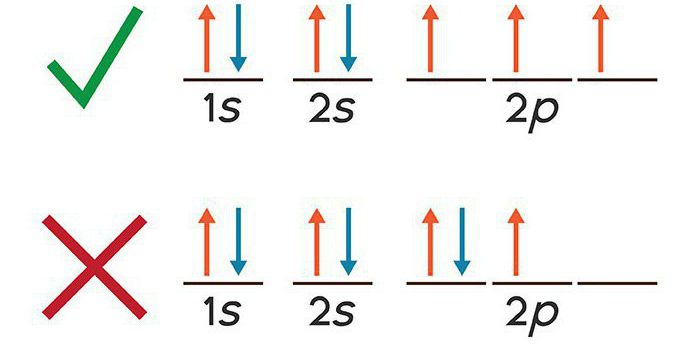
Электронная конфигурация калия записывается с учетом принципа запрета Паули. Учитывая особенности волновой природы электронов, он предположил, что каждая отрицательная частица располагается на «орбитали», то есть обладает определенным пространственным существованием. Что касается многоэлектронного атома, к которым относится калий, на каждой орбитали не может располагаться больше двух электронов. В результате было выделено четыре квантовых числа, характеризующих состояние электрона в рассматриваемый временной промежуток.
Правило Клечковского
Электронная конфигурация калия составляется на основе правила, выведенного Клечковским. Рассмотрим его подробнее. В зависимости от того, на какой орбитали располагаются электроны, они обладают определенным запасом энергии. Сначала идет распределение частиц, имеющих меньший запас энергии.
В качестве основной энергетической характеристики для электрона выступает главное квантовое число, соответствующее номеру периода.
В многоэлектронном атоме происходит не только притягивание к ядру электронов, но и отталкивание их между собой. При увеличении суммарного спина частиц происходит уменьшение энергии электронной оболочки, возрастает количество электронов, обладающих одинаковой ориентацией собственных моментов движения. Подобная зависимость в квантовой химии называется правилом Хунда.
На основе этих двух правил и составляется электронная конфигурация атома калия. Атомные спектры дают возможность определить основное состояние электронов, то есть выявить те частицы, которые обладают минимальным энергетическим запасом.
Суть построения электронной формулы для многоэлектронного атома калия достаточно проста: электронная система должна обладать минимальной энергией, соответствовать принципу запрета Паули.
Примеры распределения электронов по энергетическим уровням
Прежде чем рассматривать, какова электронная конфигурация иона калия, приведем простые примеры. В атоме водорода ядро содержит один положительный протон. Вокруг ядра по орбите вращается один электрон. В основном состоянии электронная формула водорода имеет следующий вид: 1s. Рассмотрим особенности ориентации спина у этого электрона. Согласно правилу Хунда, он сонаправлен со спином ядра.
Для гелия, имеющего второй порядковый номер в таблице элементов, два электрона располагают на одной орбитали. Каждый из них обладает ½ спина, имеет разное направление вращения.
У элементов второго энергетического уровня появляется две оболочки, каждая обладает своим запасом энергии.
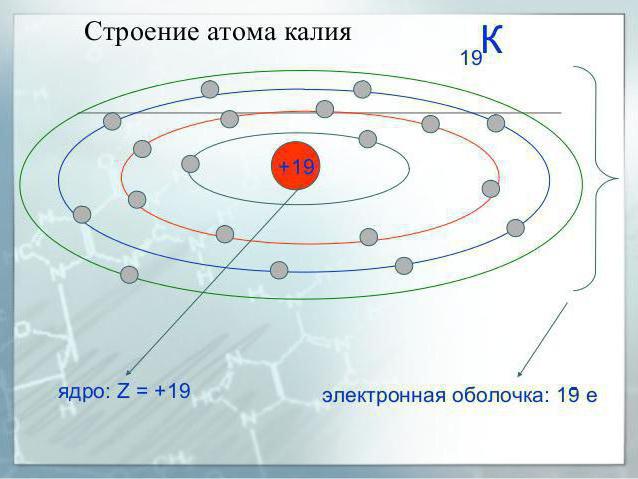
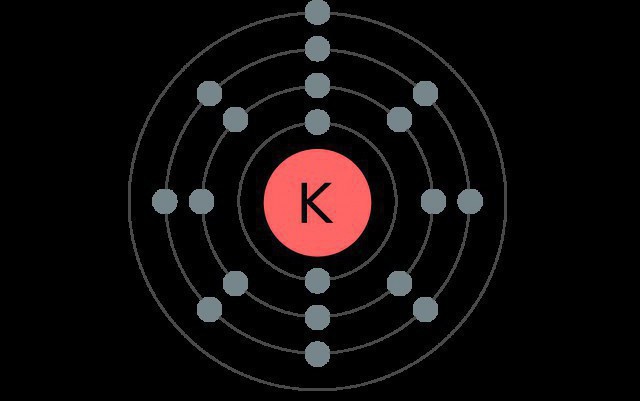
Калий является элементом четвертого периода системы элементов, поэтому у него четыре электронных уровня, каждый из которых содержит разные виды подуровней.
В нормальном состоянии атом этого щелочного металла имеет следующую конфигурацию: 1s22s22p63s23p64s1.
Электронная конфигурация иона калия имеет отличия от атома. На внешнем энергетическом уровне металла располагается один валентный электрон. Так как калий проявляет восстановительные свойства, во время взаимодействий с другими атомами он отдает валентный электрон, превращается в положительный ион (катион), имеющий следующую электронную конфигурацию: 1s22s22p63s23p64s0.
Заключение
Для каждого химического элемента, располагающегося в таблице Менделеева, можно составить электронные конфигурации, вооружившись правилом Хунда, принципом запрета Паули, а также формулой Клечковского. Помимо электронных конфигураций атомов в неорганической химии составляют и формулы катионов и анионов, образующихся в результате химических взаимодействий.




























