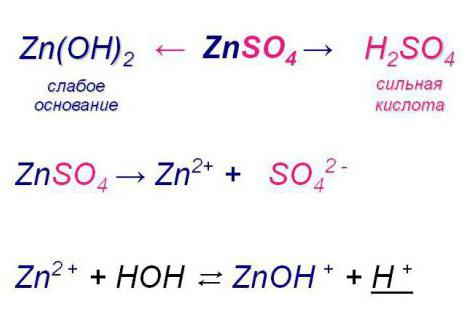Химия, как и большинство точных наук, требующих много внимания и твердых знаний, никогда не была любимой дисциплиной школьников. А зря, ведь с ее помощью можно понять множество процессов, происходящих вокруг и внутри человека. Взять, к примеру, реакцию гидролиза: на первый взгляд кажется, что она имеет значение только для ученых-химиков, но на самом деле без нее ни один организм не мог бы полноценно функционировать. Давайте узнаем об особенностях данного процесса, а также о его практическом значении для человечества.
Реакция гидролиза: что это такое?
Данным словосочетанием называется специфическая реакция обменного разложения между водой и растворяемым в ней веществом с образованием новых соединений. Гидролиз также можно назвать сольволизом в воде.

Данный химический термин образован от 2 греческих слов: «вода» и «разложение».
Продукты гидролиза
Рассматриваемая реакция может происходить при взаимодействии Н2О как с органическими, так и неорганическими веществами. Ее результат напрямую зависит от того, с чем контактировала вода, а также использовались ли при этом дополнительные вещества-катализаторы, изменялись ли температура и давление.
К примеру, реакция гидролиза соли способствует образованию кислот и щелочей. А если речь идет об органических веществах, получаются другие продукты. Водный сольволиз жиров способствует возникновению глицерина и высших жирных кислот. Если процесс происходит с белками, в результате образовывается различные аминокислоты. Углеводы (полисахариды) разлагаются на моносахариды.
В теле человека, неспособном полноценно усваивать белки и углеводы, реакция гидролиза «упрощает» их до веществ, которые организм в состоянии переварить. Так что сольволиз в воде играет важную роль в нормальном функционировании каждой биологической особи.
Гидролиз солей
Узнав, что такое реакция гидролиза, стоит ознакомиться с ее протеканием в веществах неорганического происхождения, а именно солях.
Особенностями данного процесса является то, что при взаимодействии этих соединений с водой ионы слабого электролита в составе соли отсоединяются от нее и образуют с Н2О новые вещества. Это может быль либо кислота, либо слабое основание, либо и то, и другое. Вследствие всего этого происходит смещение равновесия диссоциации воды.
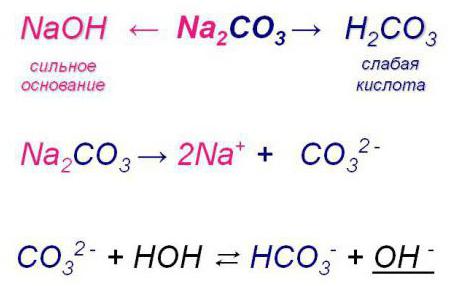
Обратимый и необратимый гидролиз
В приведенном выше примере в последнем уравнении гидролиза можно заметить вместо одной стрелки две, причем обе направлены в разные стороны. Что это значит? Данный знак сигнализирует о том, что реакция гидролиза имеет обратимый характер. На практике это означает, что, взаимодействуя с водой, взятое вещество одновременно не только разлагается на составляющие (которые позволяют возникать новым соединениям), но и образовывается вновь.

Однако не всякий гидролиз имеет обратимый характер, иначе бы он не имел смысла, так как новые вещества были бы нестабильны.
Существует ряд факторов, которые могут способствовать тому, чтобы подобная реакция стала необратимой:
- Температура. От того, повышается она или понижается, зависит то, в какую сторону смещается равновесие в происходящей реакции. Если она становится выше, происходит смещение к эндотермической реакции. Если же наоборот, температура понижается, преимущество оказывается на стороне экзотермической реакции.
- Давление. Это еще одна термодинамическая величина, активно влияющая на ионный гидролиз. Если оно повышается, химическое равновесие оказывается смещено в сторону реакции, которую сопровождает уменьшение общего количества газов. Если понижается, наоборот.
- Высокая или низкая концентрация веществ, участвующих в реакции, а также наличие дополнительных катализаторов.
Виды реакций гидролиза в солевых растворах
- По аниону (ион с отрицательным зарядом). Сольволиз в воде солей кислот слабых и сильных оснований. Такая реакция из-за свойств взаимодействующих веществ имеет обратимый характер.
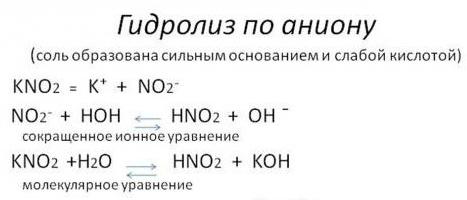
- По катиону (ион с положительным зарядом). Гидролиз соли кислоты сильной и основания слабого. Она также обратима.
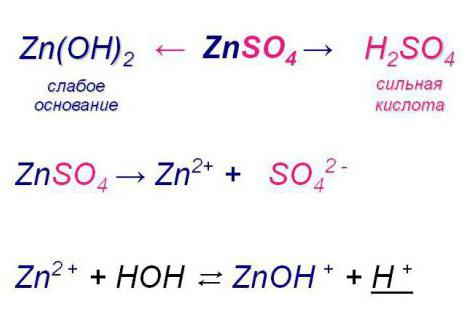
- Реакция соли слабой кислоты и слабого основания. Такой процесс можно считать практически необратимым, поскольку все новообразованные вещества покидают так называемую зону реакции, выпадая в осадок или превращаясь в газ.
- В случае если и основание, и соль кислоты – сильные, в таком растворе не происходит водный сольволиз.
Степень гидролиза
Изучая особенности гидролиза в солях, стоит обратить внимание на такое явление, как его степень. По этим словом подразумевается соотношение солей (которые уже вступили в реакцию разложения с Н2О) к общему количеству содержащегося данного вещества в растворе.
Чем слабее кислоты или основания, участвующее в гидролизе, тем выше его степень. Она измеряется в пределах 0-100 % и определяется по формуле, представленной ниже.
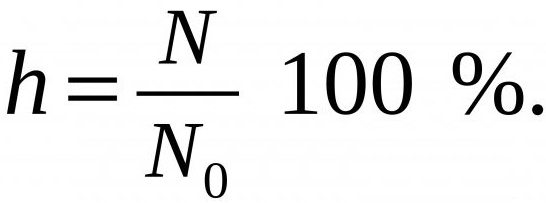
N – число молекул вещества, прошедших гидролиз, а N0 - общее их количество в растворе.
В большинстве случаев степень водного сольволиза в солях невелика. К примеру, в растворе ацетата натрия 1%-м она составляет всего 0,01 % (при температуре в 20 градусов).
Гидролиз в веществах органического происхождения
Изучаемый процесс может происходить и в органических химических соединениях.
Практически во всех живых организмах происходит гидролиз как часть энергетического обмена (катаболизма). С его помощью расщепляются белки, жиры и углеводы на легко усвояемые вещества. При этом часто сама вода редко оказывается в состоянии запустить процесс сольволиза, поэтому организмам приходится использовать различные ферменты в качестве катализаторов.
Если же речь идет о химической реакции с органическими веществами, направленной на получение новых веществ в условиях лаборатории или производства, то для ускорения и улучшения его в раствор добавляют сильные кислоты или щелочи.
Гидролиз в триглицеридах (триацилглицеринах)
Этим сложно произносимым термином именуются жирные кислоты, которые большинству из нас известны как жиры.
Они бывают как животного, так и растительного происхождения. Однако всем известно, что вода не способна растворять подобные вещества, как же происходит гидролиз жиров?
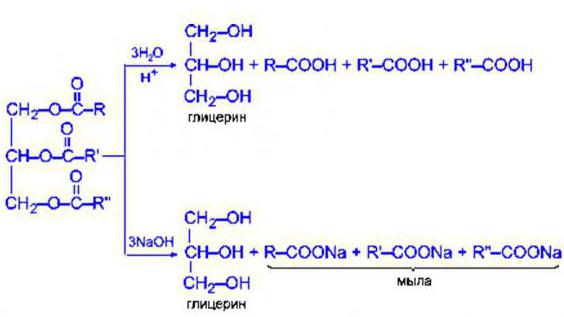
В первом случае в результате реакции образуются соли высших жирных кислот (более известные всем как мыла). Таким образом, из NaOH получается обычное твердое мыло, а из КОН – жидкое. Так что щелочной гидролиз в триглицеридах – это процесс образования моющих средств. Стоит отметить, что его можно свободно проводить в жирах как растительного, так и животного происхождения.

Рассматриваемая реакция является причиной того, что мыло довольно плохо стирает в жесткой воде и вообще не мылится в соленой. Дело в том, что жесткой называется Н2О, в которой содержится в избытке ионов кальция и магния. А мыло, попав в воду, вновь подвергается гидролизу, распадаясь на ионы натрия и углеводородный остаток. В результате взаимодействия этих веществ в воде образуются нерастворимые соли, которые и выглядят как белые хлопья. Чтобы этого не произошло, в воду добавляется гидрокарбонат натрия NaHCO3, более известный как пищевая сода. Это вещество увеличивает щелочность раствора и тем самым помогает мылу выполнять свои функции. Кстати, чтобы избежать подобных неприятностей, в современной промышленности изготавливают синтетические моющие средства из других веществ, например из солей сложных эфиров высших спиртов и серной кислоты. В их молекулах содержится от двенадцати до четырнадцати углеродных атомов, благодаря чему они не теряют своих свойств в соленой или жесткой воде.
Если среда, в которой происходит реакция, кислая, такой процесс называется кислотным гидролизом триацилглицеринов. В данном случае под действием определенной кислоты вещества эволюционируют до глицерина и карбоновых кислот.
Гидролиз жиров имеет еще один вариант - это гидрогенизация триацилглицеринов. Данный процесс используется в некоторых видах очистки, например при удалении следов ацетилена из этилена или кислородных примесей из различных систем.
Гидролиз углеводов
Рассматриваемые вещества являются одними из наиболее важных составляющих пищи человека и животных. Однако сахароза, лактоза, мальтоза, крахмал и гликоген в чистом виде организм не способен усвоить. Поэтому, так же как и в случае с жирами, эти углеводы расщепляются на усвояемые элементы с помощью реакции гидролиза.
Также водный сольволиз углеродов активно применяется и в промышленности. Из крахмала, вследствие рассматриваемой реакции с Н2О, добывают глюкозу и патоку, которые входят в состав практически всех сладостей.

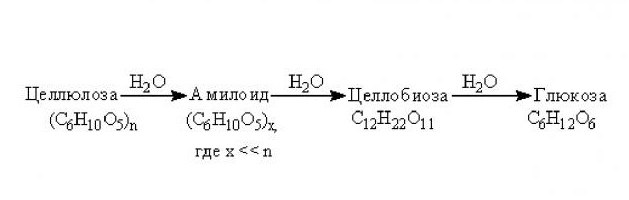
Еще один полисахарид, который активно используется в промышленности для изготовления многих полезных веществ и продуктов, – это целлюлоза. Из нее добывают технический глицерин, этиленгликоль, дрожжи кормовые, сорбит и хорошо известный всем этиловый спирт.
Гидролиз целлюлозы происходит при длительном воздействии высокой температуры и наличии минеральных кислот. Конечным продуктом этой реакции является, как и в случае с крахмалом, глюкоза. При этом стоит учитывать, что гидролиз целлюлозы проходит более сложно чем, у крахмала, поскольку этот полисахарид устойчивее к воздействию минеральных кислот. Однако поскольку целлюлоза является главной составляющей клеточных оболочек всех высших растений, сырье, ее содержащее, обходится дешевле, чем для крахмала. При этом целлюлозную глюкозу более используют для технических нужд, в то время как продукт гидролиза крахмала считается лучше пригодным для питания.
Гидролиз белков
Белки - это основной строительный материал для клеток всех живых организмов. Они состоят из многочисленных аминокислот и являются весьма важным продуктом для нормального функционирования организма. Однако являясь высокомолекулярными соединения, они могут плохо усваиваться. Чтобы упростить данную задачу, происходит их гидролиз.
Как и в случае с другими органическими веществами, данная реакция разрушает белки до низкомолекулярных продуктов, легко усваиваемых организмом.