Весь окружающий мир состоит из микроскопических частиц. Объединяясь, они образуют простые и сложные вещества различные по свойствам и характеру. Как отличить одно от другого? Чем характеризуются сложные химические вещества?
Суть вещества
Науке известно 118 химических элементов. Все они представляют атомы – наименьшие частицы, которые могут вступать в реакции. От их строения зависят химические свойства элементов. Самостоятельно они не могут существовать в природе и непременно объединяются с другими атомами. Так они образуют простые и сложные вещества.
Простыми они называются, если состоят только из одного вида атомов. Например, оксиген (О) – это элемент. Два его атома, соединенные вместе, образуют молекулу простого вещества кислорода с формулой О2. При объединении в молекулу трех атомов оксигена получается озон – О3.
Сложным веществом является соединение разных элементов. Например, вода имеет формулу H2О. Каждая её молекула состоит из двух атомов водорода (H) и одного атома кислорода. В природе таких веществ гораздо больше, чем простых. К ним относятся сахар, поваренная соль, песок и т. д.

Сложные вещества
Сложные соединения образуются в результате химических реакций, при этом происходит выделение или поглощение энергии. В ходе таких реакций в мире осуществляются сотни различных процессов, многие из них непосредственно важны для жизни живых организмов.
В зависимости от состава сложные вещества разделяют на органические и неорганические. Все они обладают молекулярным или немолекулярным строением. Если структурной единицей вещества являются атомы и ионы – это немолекулярные соединения. В нормальных условиях они твёрдые, плавятся и кипят при высоких температурах. Это могут быть соли или различные минералы.
При другом типе строения два и больше атомов объединяются в молекулу. Внутри неё связи очень прочные, но с другими молекулами она взаимодействует слабо. Они бывают в трёх агрегатных состояниях, обычно летучи, часто обладают запахом.
Органические соединения
В природе существует около трёх миллионов органических соединений. В их составе обязательно присутствует углерод. Кроме него, соединения часто содержат некоторые металлы, водород, фосфор, серу, азот и кислород. Хотя, в принципе, углерод способен соединяться практически с любыми элементами.
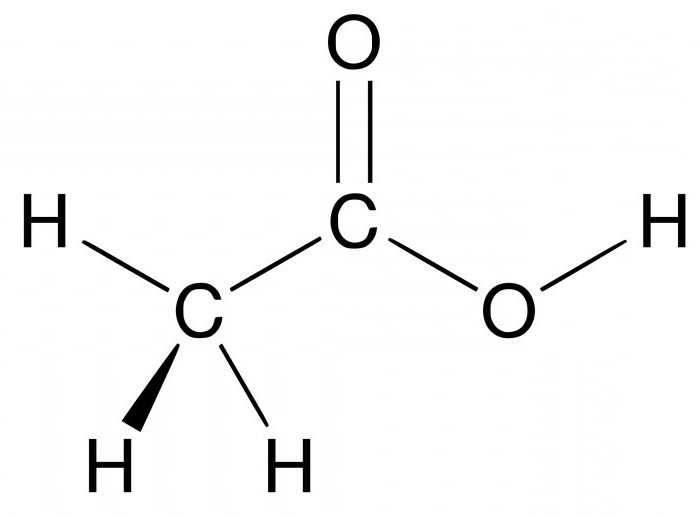
Эти вещества являются частью живых организмов. Это ценные белки, жиры, углеводы, нуклеиновые кислоты и витамины. Они встречаются в составе продуктов питания, красителей, топлива, образуют спирты, полимеры и другие соединения.
Органические вещества, как правило, имеют молекулярное строение. В связи с этим они часто существуют в жидком и газообразном состоянии. Они имеют более низкие температуры плавления и кипения, чем неорганические соединения, образуют ковалентные связи.
Углерод соединяется с другими элементами, образуя замкнутые или открытые цепочки. Главная его особенность – способность к гомологии и изомерии. Гомологи образуются, когда к паре CH2 (метан) добавляются другие пары CH2, формируя новые соединения. Метан может превращаться в этан, пропан, бутан, пентан и т. д.
Изомеры же представляют соединения с одинаковой массой и составом, но отличные по способу соединения атомов. В связи с этим их свойства тоже различны.
Неорганические соединения
Неорганические сложные вещества не содержат углерод. Исключением являются только карбиды, карбонаты, цианиды и оксиды углероды, например, мел, сода, углекислый и угарный газ и ещё некоторые соединения.
Сложных неорганических соединений в природе меньше, чем органических. Для них характерно немолекулярное строение и образование ионных связей. Они формируют горные породы и минералы, присутствуют в воде, почве и в живых организмах.

Исходя из свойств веществ, их можно разделить на:
- оксиды – связь какого-либо элемента с кислородом со степенью окисления минус два (гематит, глинозем, магнетит);
- соли – связь ионов металлов с кислотным остатком (каменная соль, ляпис, магниевая соль);
- кислоты – связь водорода и кислотного остатка (серная, кремниевая, хромовая кислота);
- основания – связь ионов металлов и гидроксидов ионов (каустическая сода, гашёная известь).






















