Кинетика ферментативных реакций рассматривается в работах Ментен и Михаэлиса. Подробно ученые описали данный вопрос в уравнении фермент-субстратного комплекса.
Определение
Особенности кинетики ферментативных реакций рассматриваются в науке о ферментах, которая изучает зависимость скорости такого процесса от химических особенностей субстрата, среды, инородных факторов, воздействующих на ход химической реакции.
При существенной концентрации субстрата, она не будет оказывать влияния на скорость процесса.
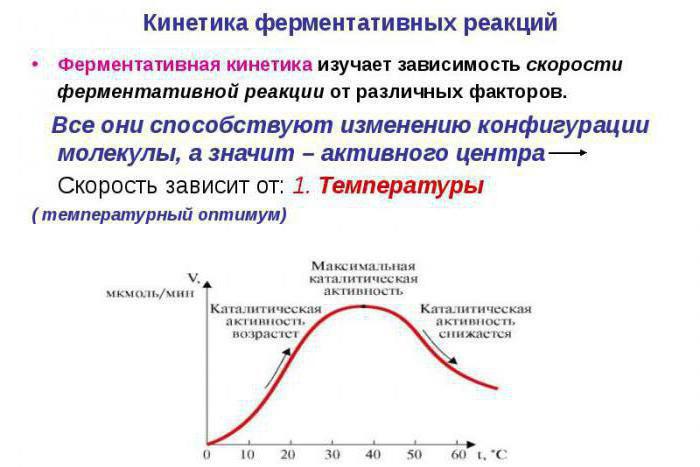
Специфика протекания
Анализ активности ферментов осуществляется при значительных концентрациях субстратов (нулевом порядке химического процесса). В подобных условиях на изменение скорости процесса будет влиять лишь количество фермента.
Кинетика ферментативных реакций в живых клетках имеет некоторые отличительные характеристики. Ферменты в них применяют не во всю силу. При избыточном количестве субстрата, что возможно в условиях эксперимента, скорость реакции будет пропорциональная количеству фермента. При существенном увеличении этого показателя, наблюдается нарушение подобной пропорциональности.
Действие модуляторов на ферменты
Кинетика ферментативных реакций объясняет линейное возрастание скорости процесса с повышением содержания субстрата. При чрезмерном росте его концентрации наблюдается уменьшение субстрата, снижается быстрота протекания химического процесса.
Кинетика ферментативных реакций подтверждает зависимость активности ферментов от рН среды, специфики фермента, его количества. Вещества, которые влияют на ход подобной реакции, именуют модуляторами либо эффекторами. Их принято подразделять на ингибиторы и активаторы, способствующие замедлению либо ускорению определенного процесса.
Основы кинетики ферментативных реакций дают возможность в полной мере понимать суть воздействия этих веществ. Часть из них считается натуральными регуляторами процесса метаболизма. Есть разные типы модуляторов активности ферментов, которые отличаются друг от друга по механизму воздействия и строению.
Варианты активаторов
Чем характеризуется кинетика ферментативных реакций? Биохимия рассматривает в качестве активаторов желчные кислоты, ионы металлов, анионы. Бывают такие ситуации, когда одно вещество в отношении одного фермента будет выступать активатором, а в ином случае является ингибитором. Специфическими активаторами для выявления ферментов выступают ионы металлов.
Они могут стимулировать процесс присоединения к ферменту субстрата, участвуют в образовании его третичной структуры либо могут выступать в качестве части активного центра.
Какова кинетика ферментативных реакций? Кратко можно отметить, что катионы многих металлов – это обязательные компоненты, необходимые для полноценной работы многих ферментов. Для некоторых из них требуется сразу несколько разных ионов. К примеру, для АТФазы, которая производит транспорт ионов через плазматическую мембрану, требуются ионы магния, натрия, калия.
Металлы могут находиться в составе простетической группы ферментов. К примеру, железо считается важным компонентом каталазы в составе порфириновых соединений. Кобальт есть в составе простетической группы метилмалонилизомеразы и гомоцистеинтрансметилазы, а марганец необходим для активации изоцитратдегидрогеназы. Есть группа ферментов, которая активируется с помощью цАМФ. Подобные ферменты именуются протеинкиназы. Она состоит из двух субъединиц:
- каталитической, которая содержит активный центр;
- регуляторная, где располагается центр связывания цАМФ.
Только при взаимодействии регуляторного центра фермента и ц-АМФ, он приобретает активность.
Кинетика ферментативных реакций: константа Михаэлиса, условия протекания, все это подробно рассматривается в физической химии.

Особенности ферментов
Они являются компактными молекулами, имеют относительную молекулярную массу от 104, диаметр от 20А. Ферменты, которые входят в состав глобулярных белков, образуются при определенном соединении пептидными связями 20 аминокислотных остатков.
Внутреннее строение ферментов в биохимии характеризуется четырьмя типами структур:
- первичная связана с генетическим кодом;
- вторичная структура характеризует спирализацию цепи;
- третичная определяет пространственное укладывание спирали полипептидной цепи;
- четверичная связана с объединением глобул в активный олигомерный фермент.
Специфика процессов с одним субстратом
Кинетика ферментативных реакций уравнения Михаэлиса - Ментен объясняет связь между скоростью и концентрациями субстрата.
В 1903 году Л. Анри допустил, что фермент с субстратом образует некое промежуточное соединение. Если сам фермент считать Е, субстрат S, в таком случае интермедиат будет иметь вид ES.
Л. Михаэлис взял для анализа кинетики данного процесса механизм, который включает в себя две стадии: обратимую, необратимую.
Кинетические уравнения двух этих процессов имеют достаточно сложный вид. Для их решения используют стационарные концентрации. Скорость получения промежуточного соединения описывается законом действующих масс, связывает между собой начальные концентрации субстрата и фермента, текущие показатели, а также концентрации промежуточного вещества и продукта взаимодействия.

Особенности решения
Каковы основные кинетики ферментативных реакций? Таблица, используемая в физической химии, позволяет решать систему уравнений в следующих случаях:
- при уменьшении концентрации исходных веществ;
- при превышении количества продукта в сравнении с промежуточным комплексом.
Для ферментативных процессов выполняется соотношение скоростей, при котором вторая константа существенно превышает величину первой. Причина в неустойчивости промежуточного соединения, его несущественной концентрации.
По решению ИЮПАК константа, позволяющая описывать кинетику химического процесса, была названа константой Михаэлиса.
Экспериментальным путем была подтверждена линейная зависимость начальной скорости от концентрации субстрата.
Физический смысл константы Михаэлиса
Для того чтобы ответить на этот вопрос, принимают концентрацию субстрата, при которой фермент проявляет половину своей активности. Константа Михаэлиса имеет такую же размерность, что и первоначальная концентрация субстрата: моль\л.
Численные параметры данной постоянной величины располагаются в пределах 10 -2-10-8 М. В ходе экспериментальных исследований было установлено, что константа Михаэлиса является функцией температуры. Она зависит от наличия иных веществ, которые выполняют в процессе роль активатора либо ингибитора.

Частный случай
Если в ходе процесса достигается состояние, при котором наблюдается равенство констант, в системе устанавливается равновесие. Это дает возможность применять в ходе анализа ферментативных процессов приближение квазиравновесных концентраций.
В итоге существенно упрощается выражение для константы Михаэлиса, она характеризует сродство фермента к используемому субстрату.
Ингибирование ферментативных процессов
В качестве таких веществ выступают реактивы, которые при введении их в реакционную систему, существенно уменьшают скорость взаимодействия. Для ферментативного катализа требуется предварительна адсорбция субстрата, его четкое ориентирование относительно активных групп каталитического центра, а для ингибирования можно ограничиться только обычного связывания ингибитора с некоторыми фрагментами адсорбционного участка.
Проявлять свойства ингибиторов соединения могут из-за образования прочных комплексов (цианиды), а также при действии на карбонильную группу с денатурацией белков.
Типы ингибирования
Эффект замедления химического взаимодействия наблюдается по нескольким причинам:
- Ингибитор конкурирует за активный центр с субстратом, создавая с ферментом неактивный центр. В случае роста концентрации субстрата, восстанавливается активность в растворе самого фермента.
- Ингибитор присоединяется к иной части молекулы белка, формируя при этом неактивный комплекс. Фермент восстанавливает свою первоначальную активность под воздействием иных веществ, не затрагивая субстрата.
Скорость процесса связана со скоростью формирования конечного продукта через концентрации, константу Михаэлиса. Последнюю величину можно определять графически, а также выражать математическим путем из формулы. При неактивном комплексе ингибитор не мешает реакции между ферментом и субстратом, но существенно снижает скорость процесса.
При статистической обработке экспериментальных данных удалось для неконкурентного ингибирования выявить основные параметры, доказать связь между величиной скорости и показателями концентраций.
Кинетика химических процессов предполагает описание особенностей всех стадий химических процессов, используя постоянные величины, уравнение Михаэлиса-Ментен. В ходе экспериментальных исследований была выявлена зависимость между скоростью ферментативного процесса и изменением концентрации продукта взаимодействия или исходного субстрата.
Кроме того, установлена связь скорости с природой фермента. Именно от его особенностей напрямую зависит активность, особенности поведения в ходе взаимодействия. Мерой активности фермента считается одна стандартная единиц, характеризующая количество фермента, катализирующее превращение к мкмоль исходного субстрата за минуту.
Ферменты широко применяются в современной медицине, от их активности напрямую зависит быстрота определения проблемы, а также качество постановки медицинского диагноза пациенту.



























