Галогены – это ярко выраженные неметаллы. К ним относится фтор, астат, йод, бром, хлор и искусственный элемент под названием унунсептий (теннессин). У этих веществ широкий ряд химических функций, и о них стоит рассказать подробней.

Высокая окислительная активность
Это первое ярко выраженное свойство, о котором нужно сказать. Все галогены обладают высокой окислительной активностью, но больше всего фтор. Далее по нисходящей: хлор, бром, йод, астат, унунсептий. Но фтор реагирует со всеми металлами без исключения. Более того, большинство из них, оказываясь в атмосфере данного элемента, самовоспламеняются, и процесс этот сопровождается выделением большого количества теплоты.
Если фтор не нагревать, то и в этом случае он будет реагировать со многими веществами-неметаллами. Например, с серой, углеродом, кремнием, фосфором. Реакции получаются сильно экзотермическими, и могут сопровождаться взрывом.
Стоит также отметить, что фтор при нагревании окисляет и все другие галогены. Схема при этом такая: Hal2 + F2 = 2HalF. И здесь Hal – это хлор, бром и йод. Причем в таких соединениях степень их окисления составляет +1.
И еще одно химическое свойство галогена-фтора – это его реакция с тяжелыми инертными газами под воздействием облучения. Их еще называют благородными. К таким газам относятся гелий, неон, аргон, криптон, ксенон, радон и недавно открытый оганесон.

Взаимодействие со сложными веществами
Это – еще одно химическое свойство галогенов. К сложным веществам, как известно, относятся соединения, состоящие из двух и более элементов. Тот же фтор проявляет себя в таких реакциях весьма энергично. Они сопровождаются взрывом. А вот, например, так в виде формулы выглядит его реакция с водой: 2F2 + 2H2O → 4HF +O2.
Хлор тоже является реакционноспособным, хотя его активность меньше, чем у фтора. Но он реагирует со всеми простыми веществами, кроме благородных газов, азота и кислорода. Вот один из примеров: Si + 2Cl2 → SiCl4 + 662kJ.
Но особенно интересна реакция хлора с водородом. Если нет должного освещения и температуры, то между ними ничего не происходит. Но если увеличить яркость и нагреть их, то произойдет взрыв, причем по цепному механизму. Реакция протекает под воздействием фотонов, квантов электромагнитного излучения, что диссоциирует молекулы Cl2 на атомы. Следом возникает целая цепь реакций, и в каждой из них получается частица, которая инициирует начало последующей стадии.
Бром
Как уже можно было заметить, больше всего сказано о фторе и чуть поменьше о хлоре. Все потому, что химические свойства галогенов последовательно уменьшаются от фтора к астату.
Бром – некая середина в их ряду. Он лучше других галогенов растворяется в воде. Получаемый раствор известен как бромная вода – мощное вещество, способное окислить никель, железо, хром, кобальт и марганец.
Если говорить о химических свойствах галогена, то стоит оговориться, что по активности он занимает промежуточное положение между пресловутым хлором и йодом. Кстати, когда он вступает в реакцию с растворами йодидов, то выделяется свободный йод. Выглядит это так: Br2 + 2Kl → I2 + 2KBr.
Также бром может вступать в реакции с неметаллами (теллуром и селеном), а в жидком состоянии взаимодействует с золотом, вследствие чего образуется трибромид AuBr3. Еще он способен присоединяться к органическим молекулам с тройной связью. Если нагреть его в присутствии катализатора, то он сможет взаимодействовать с бензолом, образуя бромбензол C6H5Br, что называется реакцией замещения.

Йод
Следующим по активности химических свойств галогенов в таблице идет йод. Его особенность заключается в том, что он образует целый ряд различных кислот. К ним относится:
- Йодоводородная. Бесцветная жидкость с резким запахом. Сильная кислота, являющаяся мощным восстановителем.
- Йодноватистая. Неустойчивая, может существовать лишь в сильно разбавленных растворах.
- Йодистая. По характеристикам такая же, как и предыдущая. Образует соли йодиты.
- Йодноватая. Кристаллическое бесцветное вещество со стеклянным блеском. Растворима в воде, склонна к полимеризации. Обладает окислительными свойствами.
- Йодная. Гигроскопичное кристаллическое вещество. Применяется в аналитической химии в качестве окислителя.
К общим химическим свойствам галогена-йода относится высокая активность. Хотя она меньше, чем у хлора с бромом, и тем более не сравнима с фтором. Самой известной реакцией является взаимодействие йода с крахмалом, результатом которого становится синее окрашивание последнего.
Астат
О нем тоже стоит сказать пару слов в продолжение обсуждения общей характеристики галогенов. Физические и химические свойства астата близки к тем, которыми обладает пресловутый йод и полоний (радиоактивный элемент). Вот его краткая характеристика:
- Образует нерастворимую соль AgAt, как и все галогены.
- Может окисляться до состояния At, как йод.
- С металлами образует соединения, проявляя степень окисления -1. Как и у всех галогенов, впрочем.
- Реагирует с йодом и бромом, образуя межгалогенные соединения. Йодид и бромид астата, если быть точнее (AtI и AtBr).
- Растворяется в азотной и соляной кислотах.
- Если воздействовать на него водородом, то образуется газообразный астатоводород – непрочная газообразная кислота.
- Как все галогены, может заместить водород в молекуле метана.
- Имеет характерное альфа-излучение. По его наличию определяется присутствие астата.
Кстати, введением астата в виде раствора в организм человека лечат щитовидную железу. В радиотерапии этот элемент используется активно.
Теннесин
И ему нужно уделить внимание, раз речь идет про химические свойства галогенов. Соединений с теннесином известно не очень много, так как пока что точные его характеристики остаются предметом обсуждения, ибо он был включен в таблицу лишь в 2014 году.
Вероятнее всего, что это – полуметалл. Он почти не проявляет окислительной способности, являясь, таким образом, самым слабым из галогенов, поскольку его электроны от ядра слишком далеко находятся. Но высока вероятность, что теннессин будет тем галогеном, восстановительное свойство которого будет выше окислительного.
Экспериментально проведена реакция с водородом. TsH – это самое простое соединение. Получившийся теннессиноводород продолжает большинство тенденций для галогенводородов.
Физические свойства
Их стоит оговорить вкратце. Итак:
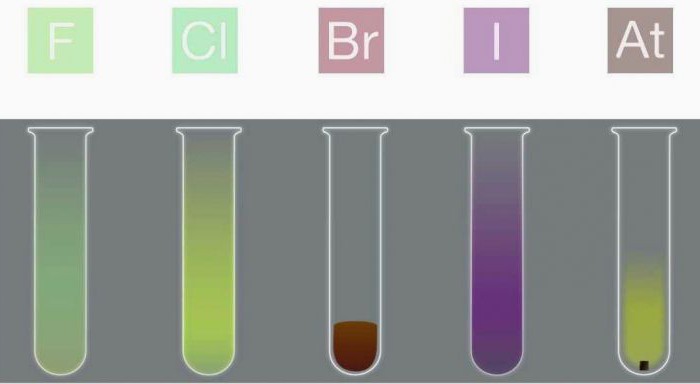
- Фтор – ядовитый светло-желтый газ с резким запахом.
- Хлор – светло-зеленый газ. Тоже имеет резкий запах и является более ядовитым, чем фтор.
- Бром – красно-бурая тяжелая жидкость. Его пары сильно ядовиты.
- Йод – темно-серое твердое вещество с металлическим блеском.
- Астат – сине-черное твердое вещество. Похоже на йод.

Получение галогенов
Об этом – напоследок. Химические свойства и получение галогенов связаны непосредственно. Первое обуславливает второе. Вот какими способами можно получить эти вещества:
- Посредством электролиза расплавов или растворов галогенидов – их соединений с другими элементами или радикалами.
- С помощью взаимодействия их твердых солей и серной концентрированной кислоты. Но это касается лишь HF и HCl.
- HBr и HI можно получить посредством гидролиза галогенидов фосфора.
- Окислением галогенводородных кислот.
- HClO получают гидролизом в водных растворах хлора.
- HOBr образуется за счет взаимодействия воды и галогена.
Но вообще способов получения намного больше, это лишь примеры. Ведь галогены широко применяются в промышленности. Фтор применяют для получения смазочных веществ, хлор используют для отбеливания и в дезинфекции, бром задействуют в медицине и производстве фотоматериалов, а про йод даже говорить не нужно.



























