Что происходит с атомами элементов во время химических реакций? От чего зависят свойства элементов? На оба эти вопроса можно дать один ответ: причина лежит в строении внешнего энергетического уровня атома. В нашей статье мы рассмотрим электронное строение атомов металлов и неметаллов и выясним зависимость между структурой внешнего уровня и свойствами элементов.
Особые свойства электронов
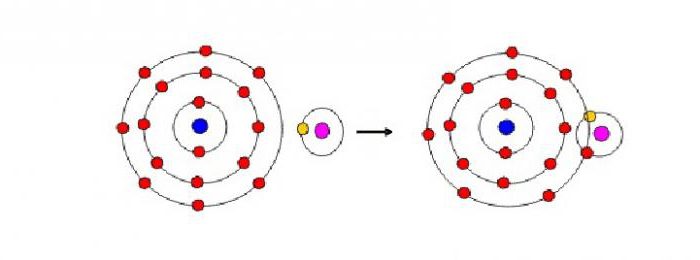
При прохождении химической реакции между молекулами двух или более реагентов происходят изменения в строении электронных оболочек атомов, тогда как их ядра остаются неизменными. Сначала ознакомимся с характеристиками электронов, находящихся на наиболее удаленных от ядра уровнях атома. Отрицательно заряженные частицы располагаются слоями на определенном расстоянии от ядра и друг от друга. Пространство вокруг ядра, где нахождение электронов наиболее возможно, называется электронной орбиталью. В ней сконденсировано около 90 % отрицательно заряженного электронного облака. Сам электрон в атоме проявляет свойство дуальности, он одновременно может вести себя и как частица, и как волна.
Правила заполнения электронной оболочки атома
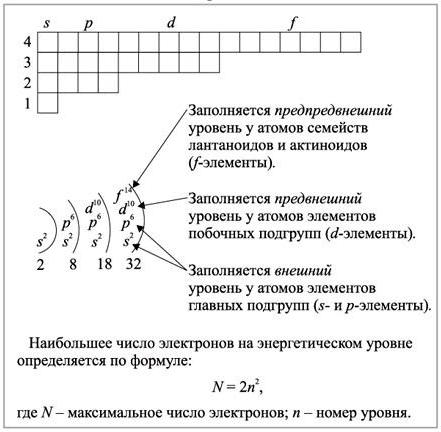
Количество энергетических уровней, на которых находятся частицы, равно номеру периода, где располагается элемент. На что же указывает электронный состав? Оказалось, что количество электронов на внешнем энергетическом уровне для s- и p-элементов главных подгрупп малых и больших периодов соответствует номеру группы. Например, у атомов лития первой группы, имеющих два слоя, на внешней оболочке находится один электрон. Атомы серы содержат на последнем энергетическом уровне шесть электронов, так как элемент расположен в главной подгруппе шестой группы и т. д. Если же речь идет о d-элементах, то для них существует следующее правило: количество внешних отрицательных частиц равно 1 (у хрома и меди) или 2. Объясняется это тем, что по мере увеличения заряда ядра атомов вначале происходит заполнение внутреннего d- подуровня и внешние энергетические уровни остаются без изменений.
Почему изменяются свойства элементов малых периодов?
В периодической системе малыми считаются 1, 2, 3 и 7 периоды. Плавное изменение свойств элементов по мере возрастания ядерных зарядов, начиная от активных металлов и заканчивая инертными газами, объясняется постепенным увеличением количества электронов на внешнем уровне. Первыми элементами в таких периодах являются те, чьи атомы имеют всего один или два электрона, способные легко отрываться от ядра. В этом случае образуется положительно заряженный ион металла.
Амфотерные элементы, например, алюминий или цинк, свои внешние энергетические уровни заполняют небольшим количеством электронов (1- у цинка, 3 – у алюминия). В зависимости от условий протекания химической реакции они могут проявлять как свойства металлов, так и неметаллов. Неметаллические элементы малых периодов содержат от 4 до 7 отрицательных частиц на внешних оболочках своих атомов и завершают ее до октета, притягивая электроны других атомов. Например, неметалл с наибольшим показателем электроотрицательности – фтор, имеет на последнем слое 7 электронов и всегда забирает один электрон не только у металлов, но и у активных неметаллических элементов: кислорода, хлора, азота. Заканчиваются малые периоды, как и большие, инертными газами, чьи одноатомные молекулы имеют полностью завершенные до 8 электронов внешние энергетические уровни.
Особенности строения атомов больших периодов
Четные ряды 4, 5, и 6 периодов состоят из элементов, внешние оболочки которых вмещают всего один или два электрона. Как мы говорили ранее, у них происходит заполнение электронами d- или f- подуровней предпоследнего слоя. Обычно это - типичные металлы. Физические и химические свойства у них изменяются очень медленно. Нечетные ряды вмещают такие элементы, у которых заполняются электронами внешние энергетические уровни по следующей схеме: металлы - амфотерный элемент – неметаллы – инертный газ. Мы уже наблюдали ее проявление во всех малых периодах. Например, в нечетном ряду 4 периода медь является металлом, цинк – амфотерен, затем от галлия и до брома происходит усиление неметаллических свойств. Заканчивается период криптоном, атомы которого имеют полностью завершенную электронную оболочку.

Как объяснить деление элементов на группы?
Каждая группа – а их в короткой форме таблицы восемь, делится еще и на подгруппы, называемые главными и побочными. Такая классификация отражает различное положение электронов на внешнем энергетическом уровне атомов элементов. Оказалось, что у элементов главных подгрупп, например, лития, натрия, калия, рубидия и цезия последний электрон расположен на s-подуровне. Элементы 7 группы главной подгруппы (галогены) заполняют отрицательными частицами свой p-подуровень.
Для представителей побочных подгрупп, таких, как хром, молибден, вольфрам типичным будет наполнение электронами d-подуровня. А у элементов, входящих в семейства лантаноидов и актиноидов, накопление отрицательных зарядов происходит на f-подуровне предпоследнего энергетического уровня. Более того, номер группы, как правило, совпадает с количеством электронов, способных к образованию химических связей.
В нашей статье мы выяснили, какое строение имеют внешние энергетические уровни атомов химических элементов, и определили их роль в межатомных взаимодействиях.