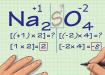В данной статье мы рассмотрим явление окисления. Это многосоставное понятие, которое фигурирует в различных областях науки, например, биологии и химии. Также мы ознакомимся с разнообразием данного процесса и его сутью.
Введение
С основной и изначальной точки зрения, окисление – это процесс химического характера, что сопровождается увеличением степени атомарного окисления вещества, которое ему подвергается. Это явление происходит, благодаря передаче электронов от одного атома (восстановителя и донора) до второго (акцептора и окислителя).

Данная терминологическая единица была введена в оборот химии в начале XIX века, а сделал это академик В.М. Севергин для создания обозначения, указывающего на взаимодействие веществ с кислородом из атмосферного воздуха.
В некоторых случаях окисление молекулы сопровождается созданием нестабильности в структуре вещества и приводит к его распаду на молекулы, обладающие большей стабильностью и маленькими размерами. Дело в том, что данный процесс повторяться может на нескольких разных уровнях измельчения. То есть, образованная более маленькая частица может также обладать более высокой степенью окисления, чем атомарные частички, что были исходными в том же веществе, но крупнее и стабильнее.
В химии есть понятие низшей и высшей степени окисления. Это позволяет классифицировать атомы по возможности их проявлять данное свойство. Высшая окислительная степень соответствует номеру группы, в котором находится элемент. Низшая степень, как правило, определяется по соответствию четного и нечетного числа: высшая 8 = низшая 2, высшая 7 = низшая 1.
Горение
Горение – это процесс окисления. В атмосферном воздухе (а также в среде чистого кислорода) могут поддаваться окислению в форме горения. Примером могут служить разнообразные вещества: простейшие элементы веществ металлов и неметаллов, неорганические и органические соединения. Однако самым практически значимым является горючее вещество (топливо), среди которых выделяют природные запасы нефти, газов, угля, торфа и т. д. Чаще всего они образуют из сложной смеси углеводородов с малой долей кислорода, серы, азотосодержащих соединений органического типа, а также включениями следового количества прочих элементов.

Биологическое окисление
В биологии реакции окисления – это процессы, что в своей совокупности сходятся к изменению степени окисления атомов, участвующих в реакции, а происходит это благодаря электронному распределению между взаимодействующими компонентами.
Первое предположение о том, что во всех живых организмах протекают сложнейшие хим. реакции, было выдвинуто в восемнадцатом столетии. Изучал проблему химик из Франции А. Лавуазье. Он обратил внимание на то, что протекание горения и окисления в биологии являются схожими друг с другом.
Учеными было совершено исследование пути кислорода, что был поглощен живом существом вследствие дыхания. Они сообщили, что данные процессы окисления – это аналогичные процессы, протекающие с разной скоростью. Он заострил внимание на процессе разложения, в основе которого, как оказалось, лежит явление взаимодействия молекулы кислорода (окислителя) с органическим веществом, включающим в себя атомы углерода и/или водорода. Вследствие разложения происходит абсолютная трансформация вещества.
Оставались моменты процесса, которые ученые не могли до конца понять, среди которых вопросы:
- По какой причине осуществляется окисление в условиях низкой температуры тела, несмотря на его наличие вне организма, только при высокой температуре.
- По какой причине реакции окисления – это явления, которые не сопровождаются выбросом пламени, а также огромными выбросами высвободившейся энергии.
- Как осуществляется «горение» питательного ряда веществ в теле, если оно на 80% (приблизительно), состоит из жидкости – воды H2O.

Виды биологического окисления
В соответствии с условиями среды, в которой происходит окисление, его делят на два вида. Большинство грибков и микроорганизмов энергетические ресурсы получают путем преобразования питательного вещества посредством анаэробного способа. Данная реакция происходит без доступа молекулярного кислорода, а также ее называют гликолизом.
Более сложным способом преобразования веществ питания является аэробная форма биологического окисления или тканевого дыхания. Отсутствие кислорода вызывает неспособность клеток осуществлять окисление для получения энергии, и они гибнут.

Получение энергии живым организмом
В биологии окисление – это многосоставное явление:
- Гликолиз – начальная стадия организмов-гетеротрофов, в ходе которого моносахариды расщепляются бескислородно, и оно предшествует началу процесса клеточного дыхания.
- Окисление пирувата – преобразования пировиноградных кислот в ацетилкоэнзим. Данные реакции возможны только с участием ферментных комплексов пируватдегидрогеназы.
- Процесс распада бета-жирных кислот – параллельно осуществляемое с окислением пирувата явление, целью которого является переработка каждой жирной кислоты в ацетилкоэнзим. Далее это вещество поставляется в цикл кислот трикарбоновой группы.
- Цикл Кребса – превращение ацетилкоэнзима в лимонные кислоты и дальнейшее подвержение последующему преобразованию (явлениям дегидрирования, декарбоксилирования и регенерации).
- Окислительное фосфорилирование – последний этап преобразования, в ходе которого эукариотический организм преобразует аденозиндифосфат в аденозинтрифосфорные кислоты.

Из этого следует, что окисление – это процесс, включающий в себя:
- явление отщепления водорода от субстрата, что подвергается окислению (дегидрированию);
- явление отдачи электрона субстратом;
- явление присоединения молекулы кислорода к субстрату.
Реакция над металлами
Окисление металла – это реакция, в ходе которой посредством взаимодействия элемента из группы металлов и O2, происходит образование окислов (оксидов).
В широком значении – реакция, в которой атом теряет электрон и создает разнообразные соединения, например, вещества хлоридов, сульфидов и т. п. В природном состоянии чаще всего металлы находиться могут лишь в полностью окисленном состоянии (в виде руды). Именно по этой причине, процесс окисления представлен в виде реакции восстановления различных компонентов соединения. Практически применяемые вещества металлов и их сплавов при взаимодействии с окружающей средой постепенно окисляются – подвергаются коррозии. Процессы окисления металлов происходят, благодаря термодинамическим и кинетическим факторам.

Валентность и окисление
Степень окисления – это валентность. Однако между ними существует некоторая разница. Дело в том, что валентностью хим. элемента человек определяет возможность атома установить определенное количество химических связей с другими видами атомов. Это обусловлено наличием у разных типов атома, соответственно, разной возможностью создавать взаимосвязь. Однако валентность может быть только в ковалентном соединении и образуется благодаря созданию между атомами общей электронной пары. Степень окисления в отличие от валентности является степенью условного заряда, которым обладает атом вещества. Она может быть положительной «+», нулевой «0» и отрицательной «-». Также степень окисления предполагает, что все связи в веществе являются ионными.
Реакция над водой
Более двух млрд лет тому назад, растительные организмы совершили один из важнейших шагов на пути к началу эволюции. Начал формироваться процесс фотосинтеза. Однако изначально подвергались фотоокислению только восстановленные вещества сероводородного типа, что были представлены на земле в крайне малых размерах. Окисление воды – это процесс, привнесший в атмосферу значительное количество молекулярного кислорода. Это позволило перейти биоэнергетическим процессам на новый аэробный уровень. Это же явление позволило образоваться озоновому экрану, который защищает жизнь на Земле.