Большую часть процессов, лежащих в основе химической технологии, составляют каталитические реакции. Это связано с тем, что при введении катализатора скорость взаимодействия веществ существенно увеличивается. При этом производителям удается сократить расходы или же получить большее количество продуктов реакции за тот же период времени. Именно поэтому изучению катализа уделяется много внимания при подготовке технологов. Однако это явление играет важную роль и в природе. Так, особые вещества регулируют протекание биохимических реакций в живых организмах, влияя тем самым на обмен веществ.

Понятие катализа
Суть этого химического явления заключается в регулировании скорости превращения веществ с использованием особых реагентов, способных замедлять или ускорять этот процесс. При этом говорят о положительном или отрицательном катализе. Существует также явление автокатализа, когда на скорость реакции влияет один из промежуточных продуктов химической реакции. Каталитические процессы разнообразны, отличаются они механизмами, агрегатным состоянием соединений и направлением.
Вещества, которые замедляют химические взаимодействия, называют ингибиторами, а ускоряющие каталитические реакции - катализаторами. И те, и другие изменяют скорость реакции путем многократного промежуточного взаимодействия с одним или несколькими ее участниками. При этом они не входят в состав продуктов и восстанавливаются после окончания цикла превращения веществ. Поэтому участие катализатора не отражают в уравнении реакции стехиометрически, а лишь указывают как условие взаимодействия веществ.
Виды каталитических реакций
По агрегатному состоянию веществ, принимающих участие в химической реакции, различают:
- гомогенные реакции - реагирующие вещества, продукты и катализатор находятся в одном агрегатном состоянии (фазе), при этом молекулы веществ равномерно распределены по всему объему;
- межфазные каталитические реакции - происходят на границе раздела несмешивающихся жидкостей, а роль катализатора сводится к переносу реагентов через нее;
- гетерогенные каталитические реакции - в них катализатор имеет отличное от реагентов агрегатное состояние, а сама она осуществляется на поверхности раздела фаз;
- гетерогенно-гомогенные реакции - инициируются на поверхности раздела с катализатором, а продолжаются в реакционном объеме;
- микрогетерогенные реакции - мелкие частички твердого катализатора образуют мицеллы по всему объему жидкой фазы.
Существует также окислительно-восстановительный катализ, сопровождающийся изменением степени окисления катализатора при взаимодействии с реагентами. Такие превращения называют каталитическими реакциями окисления и восстановления. Наиболее распространено в химическом производстве окисление диоксида серы до триоксида при получении серной кислоты.

Виды катализаторов
По агрегатному состоянию катализаторы бывают жидкие (H2SO4, Н3РО4), твердые (Pt, V2О5, Al2О3) и газообразные (BF3).
По типу вещества катализаторы классифицируют на:
- металлы - могут быть чистыми, сплавами, цельными или нанесенными на пористую основу (Fe, Pt, Ni, Cu);
- соединения металлов типа МmЭn - наиболее распространены оксиды MgO, Al2О3, МоО3 и др.;
- кислоты и основания - используются для кислотно-основных каталитических реакций, это могут быть кислоты Льюиса, Бренстеда и др.;
- комплексы металлов - в эту группу включают также соли переходных металлов, например PdCl2, Ni(СО)4;
- ферменты (они же энзимы) - биокатализаторы, ускоряющие реакции, идущие в живых организмах.
По специфике электронного строения различают d-катализаторы, имеющие d-электроны и d-орбитали, а также s,р-катализаторы, центром которых является элемент с валентными s и р-электронами.

Свойства катализаторов
Для эффективного использования к ним применяется довольно обширный список требований, изменяющийся для конкретного процесса. Но наиболее значимы следующие два свойства катализаторов:
- Специфичность, заключается в способности катализаторов влиять только на одну реакцию или ряд однотипных превращений и не воздействовать на скорость других. Так, платина чаще всего используется в органических реакциях гидрирования.
- Селективность, характеризуется способностью ускорять одну из нескольких возможных параллельно протекающих реакций, тем самым увеличивать выход наиболее важного продукта.
Скорость каталитической реакции
Причиной ускорения взаимодействия веществ является образование активного комплекса с катализатором, приводящее к снижению энергии активации.
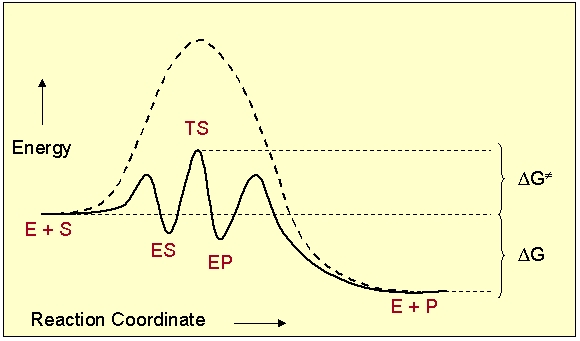
Согласно основному постулату химической кинетики, скорость любой химической реакции прямо пропорциональна произведению концентраций исходных веществ, которые взяты в степенях, соответствующих их стехиометрических коэффициентам:
v = k ∙ САх ∙ СВу ∙ СDz,
где k - константа скорости химической реакции, численно равная скорости этой же реакции, при условии, что концентрации исходных соединений равны 1 моль/л.
По уравнению Аррениуса k зависит от энергии активации:
k = A ∙ exp^(-ЕА / RT).
Указанные закономерности справедливы и для каталитических реакций. Это подтверждает и уравнение, для отношения констант скоростей:
kK / k = AК/А ∙ exp^((ЕА-ЕАК)/RT),
где переменные с индексом К относятся к каталитическим реакциям.
Стадии каталитических реакций
Для гомогенных каталитических реакций достаточно двух основных стадий:
- Образование активированного комплекса: А + К ―> АК.
- Взаимодействие активированного комплекса с другими исходными веществами: АК + В ―> С + К.
В общем виде записывают уравнение вида А + В ―> С.
Механизм гетерогенных каталитических реакций сложен. Выделяют следующие шесть стадий:
- Подведение к поверхности катализатора исходных соединений.
- Адсорбция исходных реагентов поверхностью катализатора и образование промежуточного комплекса: А + В + К ―> АВК.
- Активация образовавшегося комплекса: ΑВК ―> ΑВК*.
- Распад комплексного соединения, при этом образовавшиеся продукты адсорбированы катализатором: ΑВК* ―> CDK.
- Десорбция полученных продуктов поверхностью катализатора: CDK ―> С + D + К.
- Отвод продуктов от катализатора.
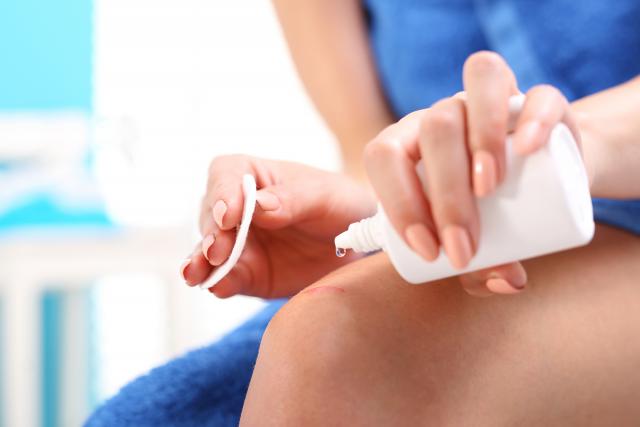
Примеры каталитических реакций
Катализаторы используют не только в химической промышленности. Любой человек в своей повседневной жизни сталкивается с различными каталитическими реакциями. Это, например, использование перекиси водорода при обработке ран. Пероксид водорода при взаимодействии с кровью начинает разлагаться под влиянием фермента каталазы:
2Н2О2 ―> О2 + 2Н2О.

В современных автомобилях система выхлопа снабжена особыми каталитическими камерами, способствующими разложению вредных газообразных веществ. Например, платина или родий помогают снижать уровень загрязнения окружающей среды оксидами азота, которые разрушаются с образованием безвредных О2 и N2.
В некоторых зубных пастах содержатся ферменты, инициирующие разложение зубного налета и остатков пищи.



























