Алкенами называют алифатические углеводороды, молекулы которых имеют одну двойную связь между атомами углерода. Также их еще принято называть олефинами (от латинского olefiant - масло), из-за хлористого этилена, полученного еще в 18-м веке, представляющего собой жидкое маслянистое вещество. Общая формула алкенов имеет вид СnΗ2n. Эти вещества, в сравнении с алканами, содержат меньшее число атомов водорода при равной длине углеродной цепи. Поэтому их называют также ненасыщенными углеводородами.
Простейший алкен
Простейшим представителем ряда алкенов является этен (он же этилен). Атомы углерода в его молекуле находятся в sp2-гибридном состоянии. Это значит, что в образовании двойной связи в алкенах участвует одна s-орбиталь и две р-орбитали.
Каждый атом углерода при двойной связи имеет по три орбитали в состоянии sp2-гибридизации и по одной р-орбитали. При перекрывании электронных облаков образуются одна σ-связь и одна π-связь, которые и образуют двойную связь. При этом π-связь гораздо слабее и под действием реагентов легко разрывается, обуславливая характерные свойства алкенов. При этом она делает невозможным вращение соседних атомов углерода вокруг оси связи.
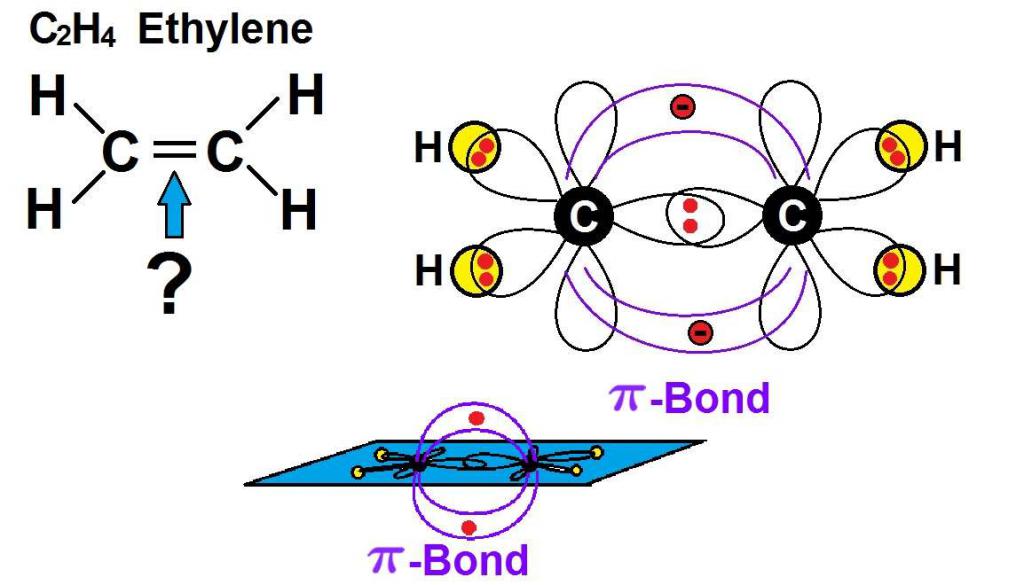
Молекула этилена имеет симметричное строение. Все атомы находятся в одной плоскости, а углы между ними равны 120°. Длина связи С=С составляет 0,134 нм.
Изомерия
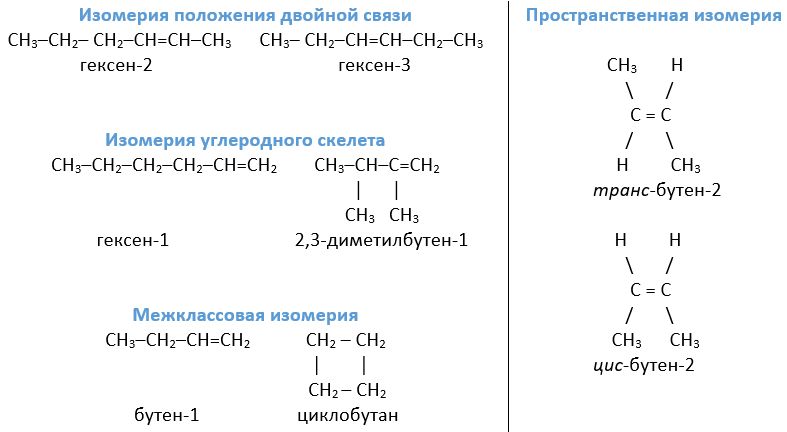
Для алкенов характерны те же виды изомерии, что и для алканов. Но к ним добавляется еще один вид - пространственная. Благодаря наличию π-связи, а вследствие этого жесткой закрепленности атомов углерода относительно друг друга, поворот по оси двойной связи невозможен без ее разрыва. Зато в молекулах алкенов наблюдается цис-транс изомерия. Для нее характерно различное расположение заместителей по отношению к плоскости π-связи. Это приводит к различиям физических и химических свойств таких изомеров. Примером могут служить транс-бутен-2 и цис-бутен-2.
Структурные формулы алкенов при изомерии положения двойной связи отличаются размещением С=С в главной цепи. Например, в молекуле гексена-2 кратная связь расположена между вторым и третьим атомами С, а в молекуле гексена-3 - между третьим и четвертым.
При изомерии углеродного скелета кратная связь имеет одинаковое размещение, но взаимное расположение атомов углерода в молекулах отличается. Так, гексен-1 имеет линейное строение, а его структурный изомер (2,3-диметилбутен-1) - разветвленное.
Межклассовая изомерия также характерна. Идентичную общую формулу с алкенами имеют циклоалканы. Например, межклассовым изомером бутена-1 будет циклобутан.
Физические свойства
По своим физическим свойствам алкены близки к алканам, и также наблюдается определенная закономерность в изменении температур плавления и кипения гомологов этена. С ростом молекулярной массы, то есть с удлинением углеводородной цепи, возрастают tкип и tпл, а также плотность.
Первые три члена ряда этилена являются газами, следующие 13 - жидкостями, и далее от алкена с формулой С18Η36 - твердые вещества. Все олефины плохо растворяются в воде, зато прекрасно растворимы в органических растворителях (таких как бензин и бензол). Легче воды.
Химические свойства
Для таких веществ характерны различные типы реакций. Большинство из них сопровождается разрывом двойной связи в результате взаимодействия алкенов с какими-либо агентами.
Реакции присоединения:
- Гидрирование (присоединение молекулы водорода):
СΗ3-СΗ=СΗ2 + Η2 ―> СΗ3-СΗ2-СΗ3.
- Галогенирование (присоединение молекулы галогена - Cl2, Br2, F2):
СΗ3-СΗ=СΗ2 + Cl2 ―> СΗ3-CΗCl-CΗ2Cl.
- Гидратация (присоединение молекулы воды):
СΗ3-СΗ=СΗ2 + Η2О ―> СΗ3-СΗ(ОН)-СН3.
- Гидрогалогенирование (присоединение молекулы галогеноводорода):
СΗ3-СΗ=СΗ2 + ΗCl ―> СΗ3-CΗCl-СΗ3.
Полимеризация
Реакцией полимеризации принято называть процесс соединения низкомолекулярных молекул мономера в крупную молекулу полимера. Вызывается этот процесс различными факторами, например, изменением давления или температуры, облучением, действием свободных радикалов. Полимеризация алкенов также сопровождается разрывом двойной связи, а за счет появившихся свободных орбиталей соседние молекулы соединяются между собой. Так из этилена получают полиэтилен, из пропена (пропилена) - полипропилен.
n СН2=СΗ2 ―> (- СΗ2 - СΗ2 -)n
n СН2=СН-СΗ3 ―> (- СΗ2 - СΗ(СΗ3) -)n
Однако не только гомологи этилена имеют важное значение в получении полимеров, но и производные алкенов с формулами C2F4 (тетрафторэтилен), С6Н5-СН=СН2 (стирол), СН2=CHCN (акрилонитрил), из которых получают тефлон, полистирол и синтетические волокна.

Окисление
Горение. Как и все углеводороды, алкены горят с образованием СО2 и Η2О:
С2Η4 + 3О2 ―> 2СО2 + 2Η2О.
Мягкое окисление перманганатом калия является качественной реакцией, поскольку происходит обесцвечивание розовой окраски раствора:
СΗ2=СΗ2 + [O] + Η2О ―> ΗО-СΗ2-СΗ2-ОΗ.
Каталитическое окисление, используемое в промышленности. Например, в присутствии PdCl2 и CuCl2 этилен окисляется до ацетальдегида:
2СΗ2=СΗ2 + О2 ―> 2СΗ3 – СОΗ.
Получение
Первые четыре представителя алкенов с формулами С2Η2, С3Η6, С4Η8 и С5Η10 выделяют из газов, образующихся при крекинге и пиролизе нефтепродуктов, а также коксовании угля:
С7Η16 ―> С3Η6 + С4Н10.

В промышленности также имеет значение способ дегидрирования алканов при повышенной температуре в присутствии катализаторов:
СΗ3-СΗ2-СΗ3 ―> СΗ3-СΗ=СΗ2 + Η2.
В лабораториях этилен получают нагреванием этилового спирта в присутствии Al2O3:
CΗ3–CΗ2–OΗ ―> CΗ2=CΗ2 + Η2O.



























