Подгруппа азота занимает пятую группу (главную подгруппу) в таблице Дмитрия Ивановича Менделеева. В нее входит несколько элементов, каждый из которых заслуживает детального изучения и рассмотрения.

Краткая характеристика
Азот является важнейшим составным элементом земной атмосферы (78% от объема). В биосфере он входит в состав белковых молекул, считается основным элементом для образования жизни на нашей планете. В литосфере элементы подгруппы азота встречаются в виде нитратов, фосфатов.
Природный азот представляет собой совокупность двух изотопов:
- 99,635% массы составляет 14 N;
- 0,365% массы включает 15 N.
Фосфор считается составным компонентом живых организмов. В природе он находится в виде фосфатов (минералов).
Висмут, сурьма, мышьяк широко встречаются в природе в составе сульфидных руд. Мышьяк – это важный элемент, отвечающий за рост волос. Его соединения ядовиты, в небольших дозах применяются в ветеринарии и медицине.
Фосфор востребован в авиации, сельском хозяйстве, медицине.
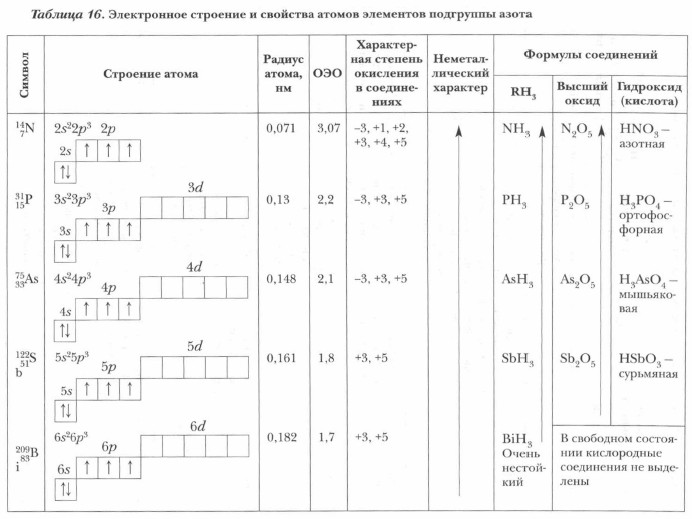
Особенности строения атомов
Подгруппа азота содержит на последнем энергетическом слое пять валентных электронов. Представители данной группы могут отдавать их в ходе химических взаимодействий либо принимать от других атомов три электрона, завершая внешний энергетический уровень. Именно поэтому подгруппа азота имеет степени окисления от -3 до +5. Высшие оксиды проявляют кислотный характер, имеют общую формулу R2 O5.
Подгруппа азота образует летучие водородные соединения состава RH3.
Изменение свойств
Элементы анализируемой подгруппы проявляют неметаллические свойства. Их способность притягивать электроны ниже, чем у представителей подгруппы халькогенов и галогенов. Чем еще отличается подгруппа азота? Свойства металлического характера (восстановительная способность) возрастают от азота к висмуту, так как возрастает радиус атома.

Физические свойства
Фосфор и азот являются типичными неметаллами, сурьма и мышьяк проявляют двойственные свойства, а висмут – это типичный металл. Практическая подгруппа азота имеет типичные физические свойства. Азот – газообразное вещество молекулярного строения, без вкуса, запаха, хорошо растворим в воде. Фосфор, обладающий тетраэдрическое строение, является мягким твердым веществом, имеющим несущественную растворимость в воде.
Мышьяк – это твердое вещество, обладающее на изломе металлическим блеском. Данное соединение нерастворимо в воде, обладает несущественной проводимостью электрического тока.
Висмут – розово-белое, кристаллическое, хрупкое вещество, которое обладает несущественной электропроводностью.

Характеристика азота
Именно этим химическим элементом начинается подгруппа азота. Общая характеристика данного элемента должна начинаться с того, что он проявляет ярко выраженные неметаллические свойства. Только азот не способен увеличивать свои валентности. У него семь электронов, которые располагаются на двух энергетических уровнях. На внешнем уровне располагается пять электронов, поэтому азот способен проявлять следующие степени окисления: - 3,+5,-2,-1,+1,+2,+3,+4.
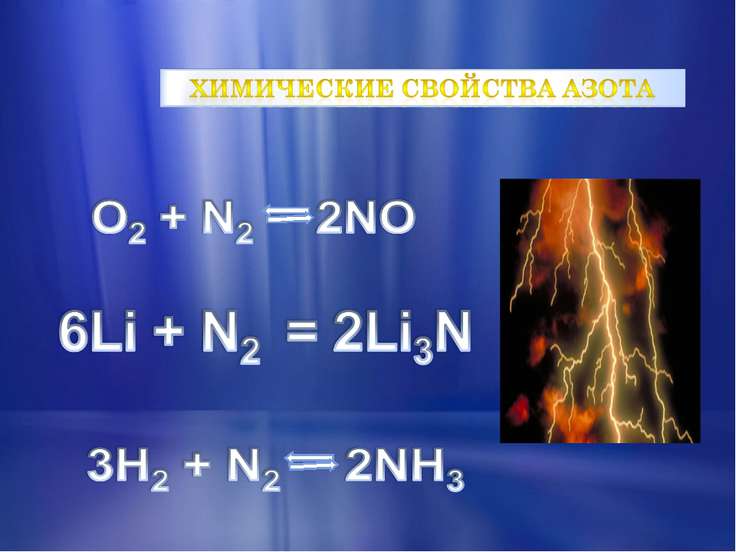
При нормальных условиях азот является молекулярным, малоактивным, газообразным веществом. Эта двухатомная молекула не вступает в реакцию с кислородом, чуть легче воздуха. При сжатии азот превращается в снегообразную массу. Данный газ не поддерживает горения, дыхания. При комнатной температуре он способен взаимодействовать только с литием, образуя его нитрид.
Чтобы разорвать молекулу азота, нужно потратить 942 кДж/моль энергии. Все химические взаимодействия, участником которых становится молекулярный азот, связаны с изменением степеней окисления, причем азот способен проявлять свойства и восстановителя, и окислителя.
При нагревании он способен взаимодействовать с металлами. При высокой температуре он реагирует с некоторыми неметаллами.
Если бы азот вступал во взаимодействия при комнатной температуре, он бы образовывал с кислородом воздуха окислы, что сделало бы невозможным существование на земле живых организмов.
Использование азота
В промышленности его получают из воздуха, применяя отличие температур кипения кислорода и азота. Это вещество используется в химической промышленности для синтеза аммиака, получения мочевины. Он нужен и для создания электрических ламп, сушке взрывчатых соединений, перекачке горючих жидкостей. Подгруппа азота и фосфора характеризуется соединениями, востребованными в разных отраслях промышленности. Остановимся на некоторых из них.

Аммиак
Его можно считать важнейшим водородным соединением азота, имеющим большое практическое значение. Бактерии перерабатывают молекулы азота в аммиак. Это бесцветный газ, который обладает резким запахом. Он существенно легче воздуха, отлично растворяется в воде. В окислительно-восстановительных процессах он проявляет восстановительные свойства. Аммиак взаимодействует с кислородом, образуя чистый азот или оксид азота (2), а с неорганическими кислотами образует соли аммония. Они нужны для изготовления взрывчатых веществ, электробатарей.
Его применяют для изготовления азотной кислоты и минеральных азотосодержащих соединений. В жидком виде он используется в холодильной промышленности. В медицине он необходим для изготовления нашатырного спирта, а в быту служит отличным средством для выведения пятен.
Оксиды азота
Пятая группа и подгруппа азота характеризуется возможностью образовывать сразу несколько видов оксидов. К примеру, азот образует целую группу соединений с кислородом.
Бурый газ (оксид азота IV) – это газообразное соединение, обладающее специфическим запахом. Вещество растворяется в воде, имеет свойства кислотного оксида, при нагревании распадается, ядовито.
Азотный ангидрид (оксид азота V) – это кристаллическое соединение белого цвета. При нагревании вещество разлагается, проявляет ядовитые свойства.

Азотная кислота и ее соли
Подгруппа азота, подгруппа углерода характеризуются образованием гидроксидов, которые имеют кислотные свойства.
В молекуле азотной кислоты находится три элемента, между которыми существуют ковалентные полярные связи. Данное молекулярное соединение, в котором азот проявляет максимальную степень окисления (+5) при валентности IV, является бесцветной жидкостью, дымящейся на воздухе, обладает едким запахом.
У концентрированной азотной кислоты желтый цвет. Ее плотность составляет 1,51 г/см3. Она растворяется в воде, проявляет свойства сильного электролита.
В разбавленном виде у азотной кислоты такие же химические свойства, что и у других минеральных кислот. При комнатной температуре азотная кислота распадается на бурый газ и воду, поэтому хранят соединение в прохладном темном месте.
Концентрированная кислота разрушает органические вещества, она способна вступать во взаимодействие даже с металлами, которые располагаются в ряду напряжений металлов после водорода.
Нитраты (соли азотной кислоты) получают при взаимодействии кислоты с металлами, основаниями, основными оксидами, аммиаком. Они являются твердыми веществами, имеющими хорошую растворимость в воде, являются сильными электролитами.
При повышении температуры происходит разложение нитратов. Качественной реакцией на нитрат-ион является взаимодействие с медными стружками (в присутствии концентрированной серной кислоты). Признаком процесса является выделение бурого газа.
Твердые соли определяют путем внесения их в пламя спиртовки. Яркая вспышка является подтверждением присутствия нитрата, так как являются взрывчатыми соединениями.

Заключение
Среди элементов, входящих в подгруппу азота, интерес представляет и фосфор. У него больший радиус атома, поэтому неметаллические свойства проявляются слабее. Данный химический элемент проявляет степени окисления 3,+3,+5. В свободном виде фосфор способен образовывать несколько аллотропных модификаций: красный, белый, черный. В химических взаимодействиях он проявляет и окислительные, и восстановительные свойства. Например, у белого фосфора молекулярная кристаллическая решетка, это вещество светится в темноте, является сильным ядом.
Красный фосфор не растворяется в воде, при нагревании до температуры плавления, он переходит в другую аллотропную модификацию.
Черный фосфор обладает полупроводниковыми свойствами, он тяжелее других аллотропных форм, внешне схож с графитом.
Среди соединений, которые образует фосфор, интерес представляют его оксиды.
Так, оксид фосфора (V) обладает гигроскопичностью, поэтому применяется в химической промышленности для осушки газообразных соединений.
При этом он превращается в аморфную массу - HPO3. В случае кипячения из оксида фосфора (V) образуется фосфорная кислота. H3PO4 является белым кристаллическим веществом, хорошо растворимым в воде. Данное соединение относится к сильным электролитам.
Большое количество фосфора расходуется на изготовление зажигательных снарядов, бомб, дымовых шашек. Соли фосфорной кислоты применяются в сельском хозяйстве в качестве минеральных удобрений. У всех элементов пятой группы (главной подгруппы) на внешнем уровне содержится одинаковое количество электронов, что можно считать общим признаком.



























