Калий является химическим элементом, которому в периодической таблице Д. И. Менделеева соответствует символ "K" (с лат. Kalium) и номер 19. С арабского языка название этого элемента переводится как "зола растений". Металл обладает яркими щелочными свойствами, имеет бело-серебристый цвет и распространен в природе в соленой воде и минералах. Химическая активность металла достаточно высокая, он легко окисляется на воздухе. Существует большое число изотопов калия, которые используются в различных областях деятельности человека.

Что такое атомные изотопы?
Перед рассмотрением вопроса об изотопах калия объясним термин "изотоп". Под изотопами атома конкретного химического элемента понимается набор атомов, которые имеют один и тот же номер в периодической системе Менделеева, но отличаются друг от друга массой ядер. При этом число протонов во всех ядрах изотопов данного элемента является одинаковым. Отличается лишь число нейтронов.
Сам термин "изотоп" ведет свое происхождение с греческого языка и состоит из двух слов: isos - равный и topos - место. Впервые этот термин начал использоваться в начале XX века английским ученым Фредериком Содди, который вошел в историю химии, как исследователь радиоактивности атомов и природы изотопов различных элементов. За свои заслуги Содди получил Нобелевскую премию в 1921 году по химии.
Отметим, что большинство химических элементов имеют более одного изотопа. Всего 8 элементов периодической таблицы обладают одним изотопом, например, натрий или бериллий. Элементом, который имеет больше всего стабильных изотопов, является олово, у него их 10.
Стабильность изотопов
Чтобы ядро атома конкретного химического элемента было стабильным, необходимо соблюдение определенного соотношения нейтронов и протонов в этом ядре. Если это соотношение нарушается, изотоп становится нестабильным и в результате процессов радиоактивности распадается на более стабильные изотопы. Понятие стабильности является относительным, поскольку многие изотопы, будучи нестабильными, имеют большой период полураспада и могут считаться относительно стабильными.
Нестабильные или радиоактивные изотопы преобразуются в более стабильные атомы. В результате этого процесса происходит испускание бета-, альфа- или гамма-излучения.
Искусственно полученные радиоактивные изотопы используются для различных техник исследования в медицине. Применение же природных радиоактивных изотопов находит себя в области геологии для определения возраста пород и живых организмов, а также при производстве атомной энергии.
Изотопы калия
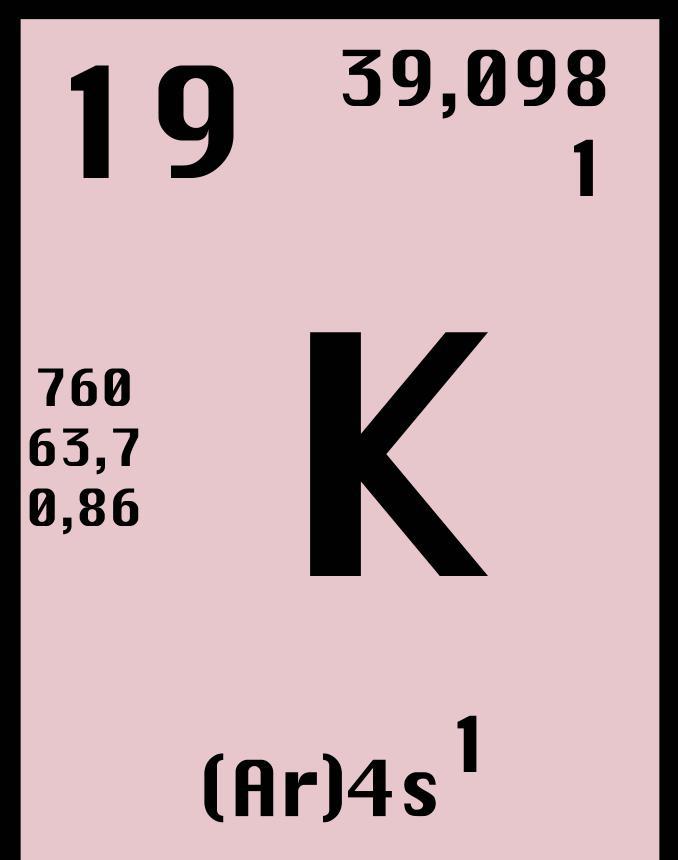
Калий имеет 24 различных изотопа. Эти изотопы обладают массой от 32 до 56 в атомных единицах массы (АЕМ). Учитывая, что калий занимает 19 порядковый номер в таблице Менделеева, значит, ядро изотопа калия содержит 19 протонов и от 13 до 37 нейтронов. Из всех этих изотопов всего три обладают большим временем жизни. Говоря более точно, отметим, что два изотопа, 39K и 41K, являются стабильными, в то время как третий изотоп, 40K, имеет большой период полураспада (1,25 миллиарда лет).
Содержание в природе калия и его изотопов
Содержание в природе изотопов калия составляет 2,4 % от массы всей земной коры, что ставит его на 7-е место в списке самых распространенных элементов на нашей планете. Из-за его высокой химической активности очень тяжело получить чистый калий. Кроме того, растворимость калия очень велика, поэтому во многих минералах он содержится в небольших концентрациях. Тем не менее на дне древних озер находятся большие количества этого элемента в виде следующих минералов:
- карналлит;
- лангбейнит;
- полигалит;
- сильвин.

Из этих минералов добыча калия является экономически целесообразной. Но калий существует в этих минералах не в виде одного изотопа. Как было выше сказано про стабильные изотопы, калий имеет три изотопа, содержание в природе которых составляет 93,3 % 39K, 6,7 % 41K и 0,012 % 40K.
Относительно стабильный изотоп K40
Радиоактивный изотоп калия 40K распадается либо за счет захвата электрона, либо за счет испускания позитрона. При этом образуется изотоп аргона 40Ar. Большой период полураспада 40K (1,248*109 лет) объясняется спин-запрещенным переходом этого изотопа в другой стабильный элемент.
В любом калийсодержащем минерале этот радиоактивный изотоп находится в достаточных количествах для демонстрации в школьных экспериментах явления радиоактивности. У людей и животных этот изотоп является главным источником их радиоактивности. Так, у человека весом 70 кг в организме находится около 4400 ядер 40K, которые распадаются каждую секунду.

Радиоактивный распад 40K на 40Ar используется в качестве одного из самых надежных методов определения возраста горных пород. Суть метода калия-аргона заключается в том, что при преобразовании гор в них не содержался аргон. В процессе времени атомы 40K распадались с образованием аргона, который задерживался в толще горных пород. Определение количества этого благородного газа, а также процентное содержание изотопов калия дает информацию о геологическом возрасте пород.
Другие радиоактивные изотопы

За исключением отмеченного изотопа 40K, все остальные изотопы этого химического элемента имеют периоды полураспада меньше 1 дня, большая же часть изотопов распадается быстрее, чем проходит минута. Почему изотопы калия, имеющие массы отличные от 39-41 АЕМ, распадаются так быстро? Дело в том, что в ядре атома калия содержится 19 протонов, а законы стабильности атомного ядра говорят, что количество нейтронов должно быть приблизительно такое же, чтобы атом мог существовать большое количество времени, не испытывая радиоактивный распад. Иными словами, чем ближе число нейтронов в ядре калия к 19, тем стабильнее будет такой изотоп.
Например, изотопы 42K и 43K (число нейтронов 23 и 24) имеют периоды полураспада 12,3 часа и 22,3 часа, соответственно. В то же время изотопы 33K и 34K (число нейтронов 14 и 15) распадаются за несколько наносекунд.



























