Третичной структурой белка называется способ укладки полипептидной цепи в трехмерном пространстве. Такая конформация возникает за счет образования химических связей между удаленными друг от друга аминокислотными радикалами. Этот процесс осуществляется при участии молекулярных механизмов клетки и играет огромную роль в придании белкам функциональной активности.
Особенности третичной структуры
Для третичной структуры белков характерны следующие типы химических взаимодействий:
- ионные;
- водородные;
- гидрофобные;
- ван-дер-ваальсовы;
- дисульфидные.
Все эти связи (кроме ковалентной дисульфидной) очень слабые, однако за счет количества стабилизируют пространственную форму молекулы.
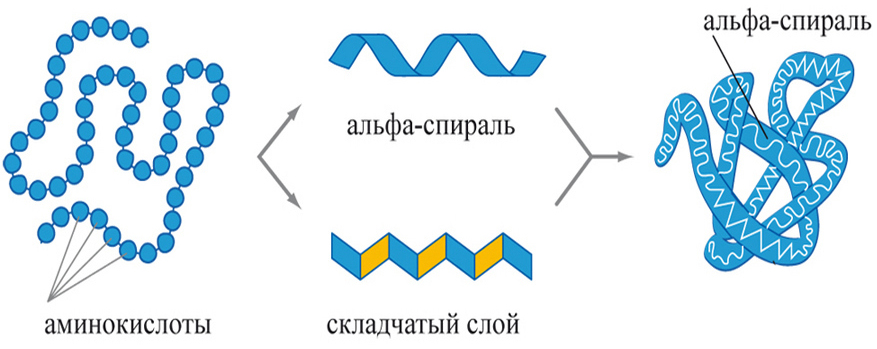
Фактически третий уровень укладки полипептидных цепей представляет собой комбинацию различных элементов вторичной структуры (α-спиралей; β-складчатых слоев и петель), которые ориентируются в пространстве за счет химических взаимодействий между боковыми аминокислотными радикалами. Для схематичного обозначения третичной структуры белка α-спирали обозначаются цилиндрами или спирально закрученными линиями, складчатые слои — стрелками, а петли — простыми линиями.
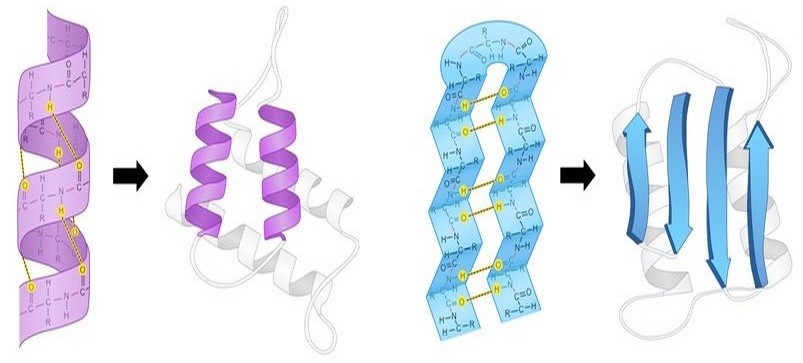
Характер третичной конформации определяется последовательностью аминокислот в цепи, поэтому двум молекулам с одинаковой первичной структурой при равных условиях будет соответствовать один и тот же вариант пространственной укладки. Такая конформация обеспечивает функциональную активность белка и называется нативной.
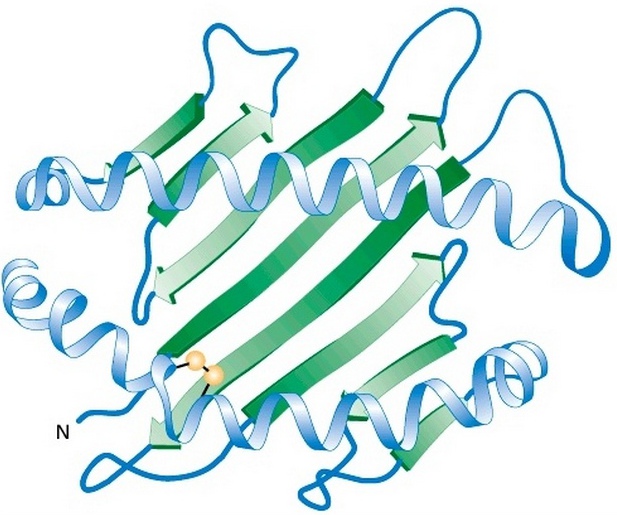
В процессе укладки белковой молекулы происходит сближение компонентов активного центра, которые в первичной структуре могут быть значительно удалены друг от друга.
Для одноцепочечных белков третичная структура является конечной функциональной формой. Сложные многосубъединичные белки образуют четвертичную структуру, которая характеризует расположение нескольких цепей по отношению друг к другу.
Характеристика химических связей в третичной структуре белка
В значительной степени сворачивание полипептидной цепи обусловлено соотношением гидрофильных и гидрофобных радикалов. Первые стремятся вступить во взаимодействие с водородом (составным элементом воды) и потому находятся на поверхности, а гидрофобные участки наоборот устремляются в центр молекулы. Такая конформация энергетически наиболее выгодна. В результате формируется глобула с гидрофобной сердцевиной.
Гидрофильные радикалы, которые все же попадают в центр молекулы, взаимодействуют друг с другом с образованием ионных или водородных связей. Ионные связи могут возникать между противоположно заряженными аминокислотными радикалами, в качестве которых выступают:
- катионные группы аргинина, лизина или гистидина (имеют положительный заряд);
- карбоксильные группы радикалов глутаминовой и аспарагиновой кислоты (имеют отрицательный заряд).
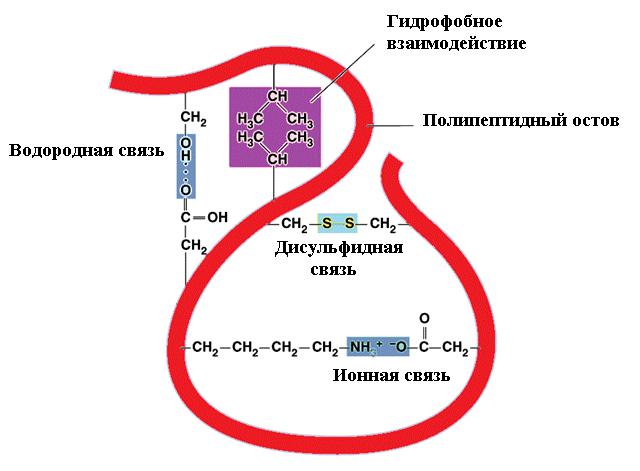
Водородные связи образуются при взаимодействии незаряженных (OH, SH, CONH2) и заряженных гидрофильных групп. Ковалентные связи (самые прочные в третичной конформации) возникают между SH-группами цистеиновых остатков, формируя так называемые дисульфидные мостики. Обычно эти группы удалены друг от друга в линейной цепи и сближаются только в процессе укладки. Дисульфидные связи не характерны для большинства внутриклеточных белков.
Конформационная лабильность
Так как связи, формирующие третичную структуру белка, очень слабые, броуновское движение атомов в аминокислотной цепи может привести к их разрыву и образованию в новых местах. Это приводит к незначительному изменению пространственной формы отдельных участков молекулы, но не нарушает нативную конформацию белка. Такое явление называют конформационной лабильностью. Последняя играет огромную роль в физиологии клеточных процессов.
На конформацию белка влияют его взаимодействия с другими молекулами или изменения физико-химических параметров среды.
Как образуется третичная структура белка
Процесс укладки белка в нативную форму называется фолдингом. В основе этого явления лежит стремление молекулы принять конформацию с минимальным значением свободной энергии.
Ни один белок не нуждается в посредниках-инструкторах, которые будут определять третичную структуру. Схема укладки изначально "записана" в последовательности аминокислот.
Однако при обычных условиях, для того чтобы крупная белковая молекула приняла нативную конформацию соответственно первичной структуре, ей потребовалось бы более триллиона лет. Тем не менее в живой клетке этот процесс длится всего лишь несколько десятков минут. Столь значительное сокращение времени обеспечивается участием в фолдинге специализированных вспомогательных белков — фолдаз и шаперонов.
Сворачивание маленьких белковых молекул (до 100 аминокислот в цепи) происходит достаточно быстро и без участия посредников, что показали эксперименты in vitro.
Факторы фолдинга
Участвующие в фолдинге вспомогательные белки делятся на две группы:
- фолдазы — обладают каталитической активностью, требуются в количестве, значительно уступающем концентрации субстрата (как и другие ферменты);
- шапероны — белки с разнообразными механизмами действия, нужны в концентрации, сопоставимой с количеством сворачиваемого субстрата.
Оба типа факторов участвуют в фолдинге, но не входят в состав конечного продукта.
Группу фолдаз представляют 2 фермента:
- Протеиндисульфидизомераза (ПДИ) — контролирует правильное образование дисульфидных связей в белках с большим количеством остатков цистеина. Эта функция очень важна, поскольку ковалентные взаимодействия очень прочные, и в случае возникновения ошибочных соединений белок не смог бы самостоятельно перестроиться и принять нативную конформацию.
- Пептидил-пролил-цис-транс-изомераза — обеспечивает изменение конфигурации радикалов, расположенных по бокам от пролина, что изменяет характер изгиба полипептидной цепи на этом участке.
Таким образом, фолдазы выполняют корректирующую роль в образовании третичной конформации белковой молекулы.
Шапероны
Шапероны иначе называются белками теплового шока или стресса. Это связано со значительным увеличением их секреции при отрицательных воздействиях на клетку (температура, радиация, тяжелые металлы и т. д.).
Шапероны принадлежат к трем семействам белков: hsp60, hsp70 и hsp90. Эти протеины выполняют множество функции, включая:
- защиту белков от денатурации;
- исключение взаимодействия только что синтезированных белков друг с другом;
- предупреждение образования неправильных слабых связей между радикалами и их лабиализация (исправление).
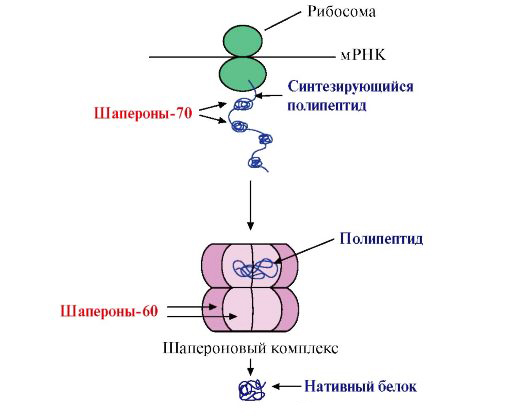
Таким образом, шапероны способствуют быстрому приобретению энергитически правильной конформации, исключая случайный перебор множества вариантов и ограждая еще не созревшие белковые молекулы от ненужного взаимодействия друг с другом. Кроме этого, шапероны обеспечивают:
- некоторые виды транспортировки белков;
- контроль рефолдинга (восстановления третичной структуры после ее утраты);
- поддержание состояния неоконченного фолдинга (для некоторых белков).
В последнем случае молекула шаперона остается связанной с белком по завершении процесса укладки.
Денатурация
Нарушение третичной структуры белка под воздействием каких-либо факторов называется денатурацией. Потеря нативной конформации происходит при разрушении большого количества слабых связей, стабилизирующих молекулу. При этом белок теряет свою специфическую функцию, но сохраняет первичную структуру (пептидные связи во время денатурации не разрушаются).
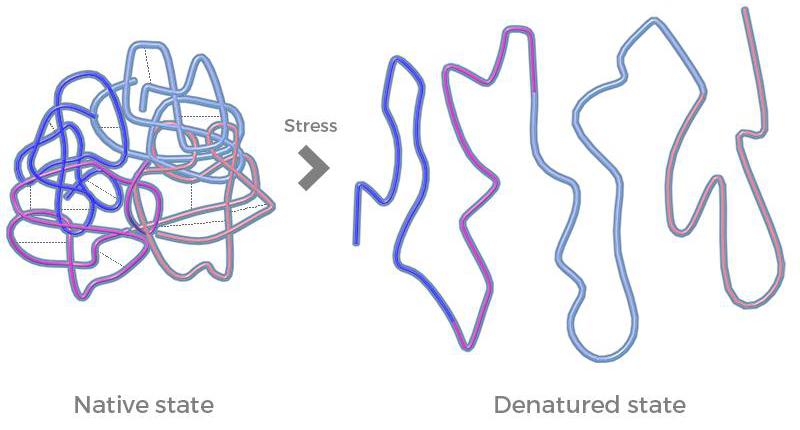
При денатурации происходит пространственное увеличение белковой молекулы, а гидрофобные участки вновь выходят на поверхность. Полипептидная цепь приобретает конформацию беспорядочного клубка, форма которого зависит от того, какие связи третичной структуры белка были разорваны. В таком виде молекула более восприимчива к воздействию протеолитических ферментов.
Факторы, нарушающие третичную структуру
Существует целый ряд физико-химических воздействий, способных вызвать денатурацию. К ним относят:
- температуру выше 50 градусов;
- радиацию;
- изменение pH среды;
- соли тяжелых металлов;
- некоторые органические соединения;
- детергенты.
После прекращения денатурирующего воздействия белок может восстановить третичную структуру. Этот процесс называется ренатурацией или рефолдингом. В условиях in vitro такое возможно только для небольших белков. В живой клетке рефолдинг обеспечивают шапероны.