Аллостерической регуляцией называют механизм, основанный на изменении пространственной конформации фермента в результате его связывания с лигандом-модулятором. Этот процесс имеет обратимый характер и может оказывать как активационный (положительный), так и ингибирующий (отрицательный) эффект. Ферменты с таким типом регуляции называют аллостерическими, а оказываемое на них воздействие — аллостерией (от греческого allos - "иной" и stereo — "пространственный").
Аллостерические ферменты
Аллостерические ферменты характеризуются двумя ключевыми особенностями:
- каталитическая активность зависит не только от концентрации субстрата;
- могут изменять пространственную структуру при взаимодействии с лигандом, что влияет на сродство активного центра к субстрату (эффективность связывания).
Большинство ферментов этой группы представляют собой олигомерные белки, состоящие из 2 и более субъединиц, связанных друг с другом нековалентными взаимодействиями (четвертичная структура).
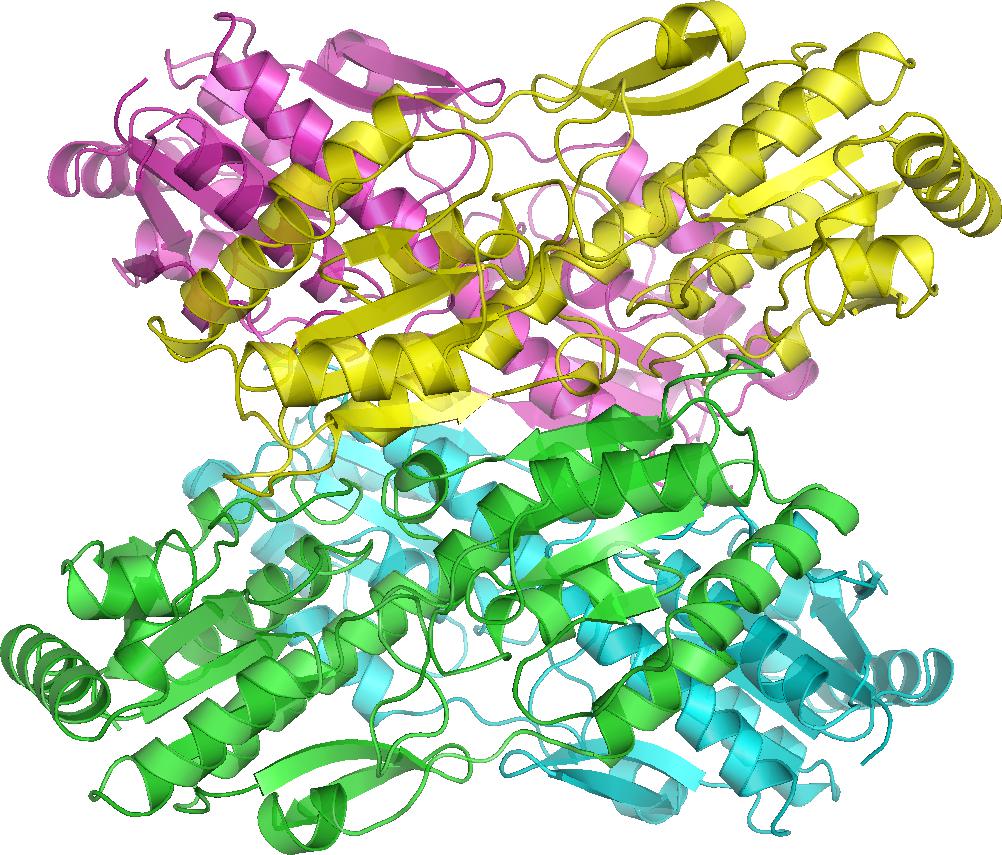
Каждая субъединица имеет 2 функциональные формы, которые могут сменять друг в друга в зависимости от связывания с конкретным модулятором:
- R-конформация (от англ. relax — расслабление) имеет высокое сродство к субстрату.
- Т-конформация (от англ. tennse — напряжение) характеризуется низким сродством.
Смена конформаций отдельных протомеров приводит к изменению активности всего фермента.
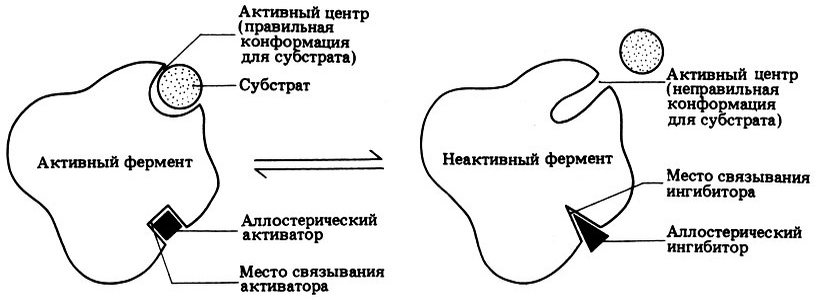
Кроме активного центра аллостерические ферменты имеют один или несколько регуляторных, предназначенных для связывания с эффекторами. Чаще всего эти 2 типа центров пространственно удалены друг од друга, но у некоторых белков совпадают. В таком случае один участок является бифункциональным (может выполнять как каталитическую, так и регуляторную роль). Аллостерические центры обладают специфичностью к конкретному модулятору, которая может иметь абсолютный или групповой характер.
Аллостерические эффекторы
Лиганды, модифицирующие конформацию ферментов, называют аллостерическими эффекторами (или модуляторами), которые подразделяют на 2 группы:
- отрицательные эффекторы (ингибиторы) снижают ферментативную активность;
- положительные эффекторы (активаторы) увеличивают ферментативную активность.
В качестве модуляторов часто выступают низкомолекулярные клеточные метаболиты, а иногда и сам субстрат. Аллостерический фермент может содержать несколько регуляторных центров, одни из которых предназначены для активаторов, а другие — для ингибиторов.
Гомотропная и гетеротропная регуляция
Лиганд, влияющий на конформацию белка, зачастую отличен от субстрата (вещества, с которым связывается активный центр фермента, чтобы катализировать реакцию). В таком случае говорят о гетеротропной регуляции.
В некоторых ситуациях одно вещество одновременно является и лигандом, и субстратом. Такая регуляция называется гомотропной и встречается значительно реже. Она характерна для метаболических путей, где требуется быстрая переработка накопленного в избытке субстрата. У гомотропных ферментов активный и регуляторный центры совпадают.
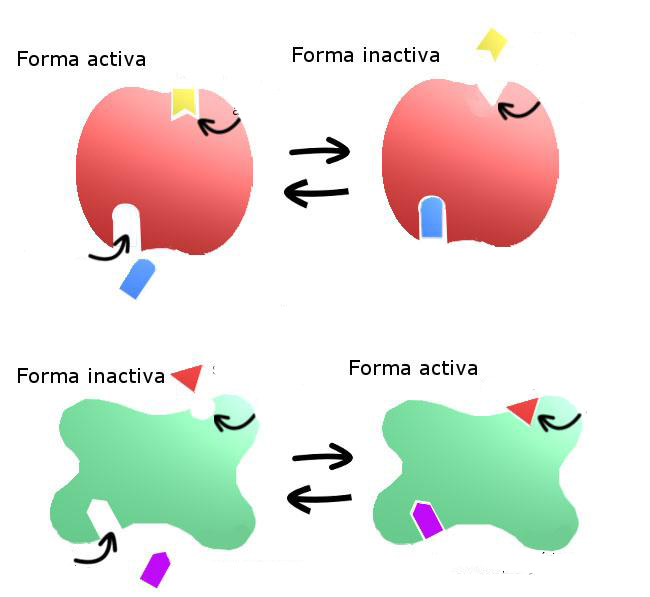
Регуляция активности ферментов путем аллостерического модифицирования
Суть алостерической модификации заключается в изменении сродства фермента к субстрату путем конформационной перестройки всей молекулы. Например, в процессе ингибирования связывание отрицательного эффектора с регуляторным участком заставляет белок приобрести конформацию, которая выводит из строя активный центр.
Положительный эффектор действует противоположным образом. Он вызывает пространственную перестройку, повышающую вероятность связывания каталитического центра с субстратом.
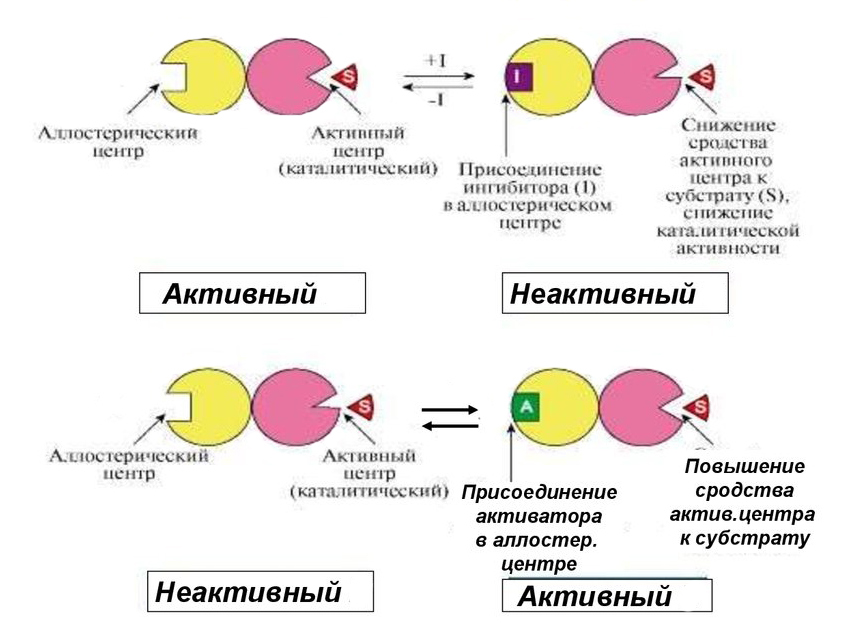
Аллостерическая регуляция имеет следующие особенности:
- связывание эффектора с ферментом нековалентно;
- каталитический и регуляторный центры находятся на разных протомерах с соответствующими названиями;
- работа аллостерических ферментов не соответствует кинетической модели Михаэлиса - Ментен;
- регуляция имеет обратимый характер (при отсоединении лиганда фермент восстанавливает первоначальную каталитическую активность).
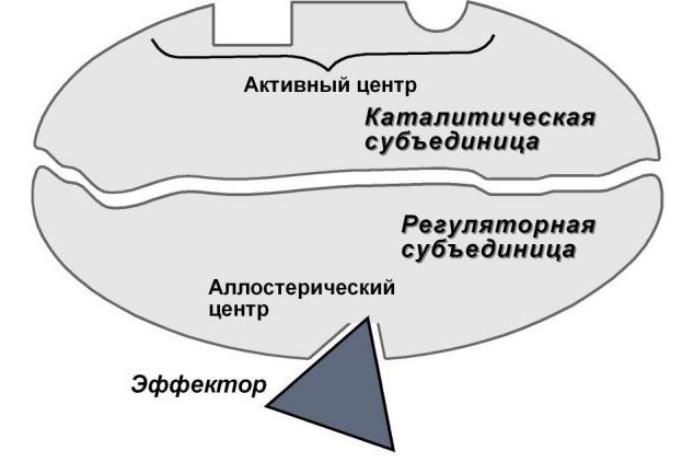
Условием работы данного механизма является конформационная взаимосвязь между каталитическим и регуляторным протомерами. Поэтому в основе аллостерической регуляции олигомерных ферментов лежит кооперативный эффект, распостраняющий влияние модулятора на всю молекулу.
Кооперативный эффект
Изменение конформации одной из субъединиц аллостерического фермента влечет за собой пространственную перестройку всех других. Это явление называют кооперативным эффектом. Последний может осуществляться двумя путями: симметричным и последовательным.
В первом случае практически все субъединицы находятся в одной и той же конформации (R или Т). К примеру, двухсубъединичный фермент может состоять из протомеров либо RR, либо TT, но не RT. При связывании с субстратом все субъединицы меняют конформацию одновременно.
Согласно последовательной модели в одной молекуле могут одновременно присутствовать протомеры разных конформаций, а их смена происходит поочередно, от одной субъединицы к другой.
В зависимости от того, как в результате меняется работа активного центра, коопиративность бывает отрицательная либо положительная.
Механизмы сопряжения и сцепления
Механизмы аллостерической регуляции активности ферментов основаны на принципах сопряжения и сцепления, которые характеризуют влияние лиганд-связывающего и активного центров фермента друг на друга.
Принцип сопряжения действует тогда, когда субстрат и модулятор имеют положительное сродство к одной и той же конформации фермента. В таком случае связывание белка с одним из этих лигандов будет увеличивать сродство к другому. В результате присутствие модулятора повышает эффективность активного центра.
Негативный механизм аллостерической регуляции работает в том случае, когда субстрат и модулятор предпочитают для связывания разные конформации фермента. Тогда присутствие одного лиганда препятствует присоединению другого. Как следствие, активный центр связанного с модулятором фермента теряет сродство к субстрату. Этот механизм называется сцеплением.
Отличие аллостерической модификации от неконкурентного ингибирования
В биохимических процессах клетки существуют 2 механизма, которые по некоторым признакам напоминают аллостарическую регуляцию — неконкурентное и смешанное ингибирование, для которых характерно присоединение лиганда к участку, отличному от активного центра. Однако это не всегда приводит к конформационным изменениям, вызывающим переход активной формы фермента в неактивную. Кроме того, данный процесс имеет совсем другие кинетические характеристики, поэтому неконкурентные ингибиторы и отрицательные эффекторы не являются идентичными понятиями.
Еще одно отличие аллостерической регуляции заключается в том, что она может иметь не только негативный, но и позитивный характер. Подавление активности фермента очень часто осуществляется по механизму обратной связи, который иначе называется ретроингибированием, а распространенной формой позитивной регуляции является активация предшественником (форактивация).
Ретроингибирование и форактивация
Частным случаем аллостерической регуляции ферментов является ингибирование каталитической активности по механизму обратной связи (ретроингибирование). В таком случае продукт многоступенчатой реакции проявляет себя как отрицательный эффектор. Этот механизм предотвращает затрату энергии на избыточное накопление синтезируемого вещества.
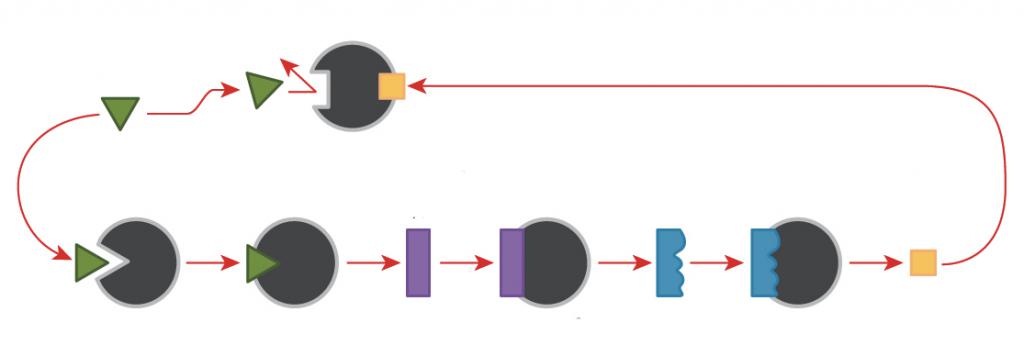
Форактивация представляет собой процесс активации фермента, при которой положительным эффектором является первичный метаболит реакции.
Роль аллостерического механизма регуляции в метаболизме клетки
Биологическая ценность аллостерических ферментов в метаболизме заключается в их способности реагировать на малейшие изменения состояния клетки и тонко регулировать биохимические реакции. Аллостерический механизм полезен в следующих случаях:
- анаболические реакции — ретроингибирование и форактивация регулируют синтез продукта;
- катаболические процессы — при достаточной концентрации АТФ его синтез ингибируется по механизму обратной связи;
- обеспечение координации и баланса между анаболизмом и катаболизмом — молекулы АДФ и АТФ выполняют роль аллостерических эффекторов с противоположным действием;
- координация между параллельными метаболическими путями (например, синтез пуриновых и пиримидиновых оснований).
Аллостерическая регуляция метаболизма связывает реакционные цепочки многоэтапных процессов. В таком случае продукт предыдущего метаболического пути является положительным эффектором для следующего.