Количественный анализ - это большой раздел аналитической химии, позволяющий определить количественный (молекулярный или элементный) состав объекта. Количественный анализ получил широкое распространение. Он применяется для определения состава руд (для оценки степени их очистки), состава почв, растительных объектов. В экологии методами количественного анализа устанавливают содержание токсинов в воде, воздухе, почве. В медицине с его помощью выявляют подделки лекарств.
Задачи и методы количественного анализа

Основная задача количественного анализа - установление количественного (процентного или молекулярного) состава веществ.
В зависимости от того, каким путем решается эта задача, выделяют несколько методов количественного анализа. Их существует три группы:
- Физические.
- Физико-химические.
- Химические.
Первые базируются на измерении физических свойств веществ – радиоактивности, вязкости, плотности и др. Самые распространенные физические методы количественного анализа - это рефрактометрия, рентгеноспектральный и радиоактивационный анализ.
В основе вторых лежит измерение физико-химических свойств определяемого вещества. К ним относятся:
- Оптические – спектрофотометрия, спектральный анализ, колориметрия.
- Хроматографические – газо-жидкостная хроматография, ионообменная, распределительная.
- Электрохимические – кондуктометрическое титрование, потенциометрическое, кулонометрическое, электровесовой анализ, полярография.
В основе третьих в списке методов лежат химические свойства исследуемого вещества, химические реакции. Химические методы разделяют на:
- Весовой анализ (гравиметрия) – базируется на точном взвешивании.
- Объемный анализ (титрование) – базируется на точном измерении объемов.
Методы количественного химического анализа
Наибольшее значение имеют гравиметрический и титриметрический. Их называют классическими методами химического количественного анализа.
Постепенно классические методы уступают свое место инструментальным. Однако они остаются самыми точными. Относительная погрешность этих методов всего 0,1-0,2%, а у инструментальных – 2-5%.
Гравиметрия
Сущность гравиметрического количественного анализа – это выделение интересующего вещества в чистом виде и его взвешивание. Выделение вещества чаще всего проводят осаждением. Иногда определяемый компонент нужно получить в виде летучего вещества (метод отгонки). Так можно определить, например, содержание в кристаллогидратах кристаллизационной воды. Методом осаждения определяют кремниевую кислоту при обработке горных пород, железо и алюминий при анализе горных пород, калий и натрий, органические соединения.
Аналитический сигнал в гравиметрии – масса.
Методика количественного анализа гравиметрией включает этапы:
- Осаждение соединения, которое содержит интересующее вещество.
- Фильтрование получившейся смеси для извлечения осадка от надосадочной жидкости.
- Промывание осадка для устранения надосадочной жидкости и удаления с его поверхности примесей.
- Высушивание при низких температурах для удаления воды или при высоких для перевода осадка в подходящую для взвешивания форму.
- Взвешивание получившегося осадка.
Недостатки гравиметрического количественного анализа – это длительность определения и неселективность (реагенты-осадители редко бывают специфичными). Поэтому необходимо предварительное разделение.
Расчеты при гравиметрическом методе
Результаты количественного анализа, проведенного гравиметрией, выражают в массовых долях (%). Для расчета необходимо знать массу навески исследуемого вещества - G, массу полученного осадка - m и его формулу для определения фактора пересчета F. Формулы для расчета массовой доли и фактора пересчета представлены ниже.

Можно вычислить массу вещества в осадке, для этого используется фактор пересчета F.
Гравиметрический фактор – постоянная величина для данного исследуемого компонента и гравиметрической формы.
Титриметрический (объемный) анализ
Титриметрический количественный анализ – это точное измерение объема раствора реагента, который расходуется на эквивалентное взаимодействие с интересующим веществом. При этом концентрация используемого реагента устанавливается предварительно. Учитывая объем и концентрацию раствора реагента, рассчитывают содержание интересующего компонента.
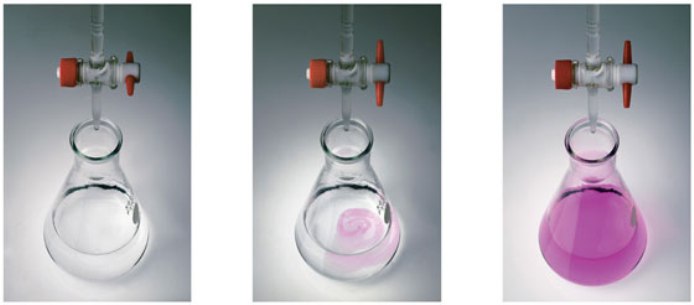
Название «титриметрический» происходит от слова «титр», которое обозначает один из способов выражения концентрации раствора. Титр показывает, сколько грамм вещества растворено в 1 мл раствора.
Титрование – процесс постепенного доливания раствора с известной концентрацией к конкретному объему другого раствора. Его продолжают до момента, когда вещества прореагируют друг с другом полностью. Этот момент называют точкой эквивалентности и определяют по изменению окраски индикатора.
Методы титриметрического анализа:
- Кислотно-основный.
- Окислительно-восстановительный.
- Осадительный.
- Комплексонометрический.
Основные понятия титриметрического анализа
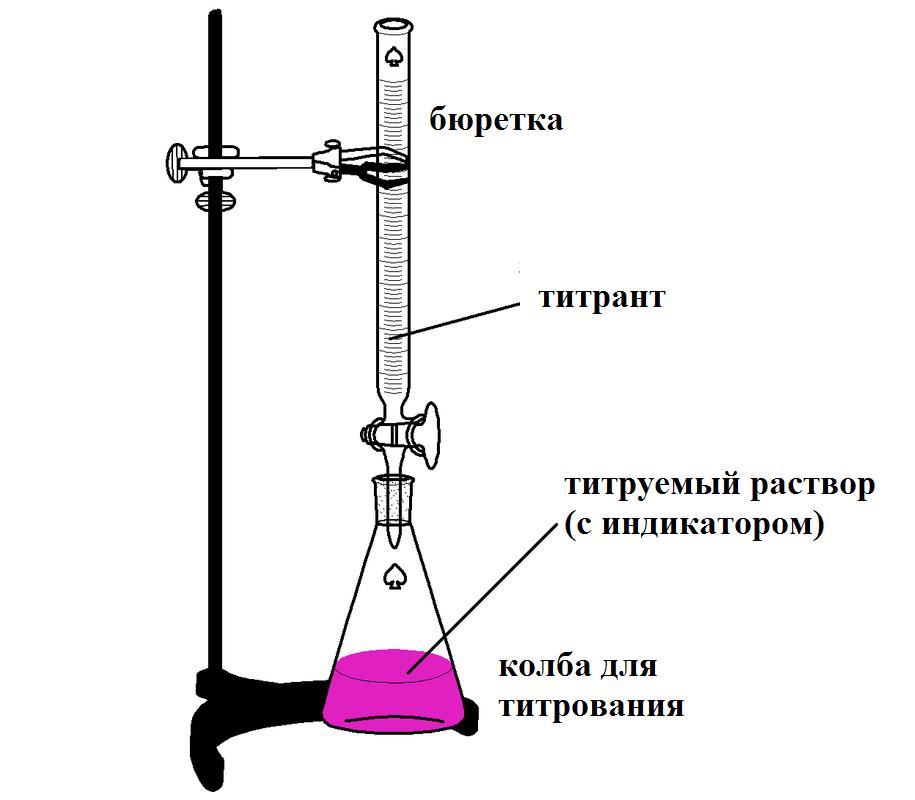
В титриметрическом анализе используются следующие термины и понятия:
- Титрант – раствор, который приливают. Его концентрация известна.
- Титруемый раствор – жидкость, к которой приливают титрант. Его концентрацию нужно определить. В колбу обычно помещают титруемый раствор, а в бюретку – титрант.
- Точка эквивалентности – тот момент титрования, когда число эквивалентов титранта становится равным числу эквивалентов интересующего вещества.
- Индикаторы – вещества, применяемые для установления точки эквивалентности.
Стандартные и рабочие растворы
Титранты бывают стандартные и рабочие.
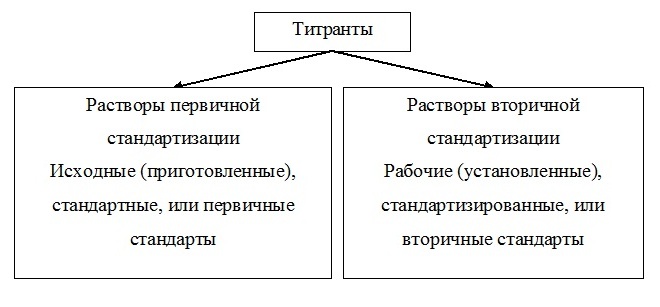
Стандартные получаются при растворении точной навески вещества в определенном (обычно 100 мл или 1л) объеме воды или другого растворителя. Так можно приготовить растворы:
- Хлорида натрия NaCl.
- Дихромата калия K2Cr2O7.
- Тетрабората натрия Na2B4O7∙10H2O.
- Щавелевой кислоты H2C2O4∙2H2O.
- Оксалата натрия Na2C2O4.
- Янтарной кислоты H2C4H4O4.
В лабораторной практике стандартные растворы готовят, используя фиксаналы. Это определенное количество вещества (или его раствора), находящееся в запаянной ампуле. Такое количество рассчитано на приготовление 1 л раствора. Фиксанал может храниться долгое время, поскольку находится без доступа воздуха, за исключением щелочей, которые реагируют со стеклом ампулы.
Некоторые растворы невозможно приготовить с точной концентрацией. Например, концентрация перманганата калия и тиосульфата натрия изменяется уже при растворении за счет их взаимодействия с парами воды. Как правило, именно эти растворы нужны для определения количества искомого вещества. Раз их концентрация неизвестна, ее нужно определить перед титрованием. Данный процесс называют стандартизацией. Это установление концентрации рабочих растворов их предварительным титрованием стандартными растворами.
Стандартизация необходима для растворов:
- Кислот – серной, соляной, азотной.
- Щелочей.
- Перманганата калия.
- Нитрата серебра.
Выбор индикатора
Для точного определения точки эквивалентности, то есть момента окончания титрования, необходим правильный выбор индикатора. Это вещества, изменяющие свой цвет, в зависимости от значения рН. Каждый индикатор изменяет цвет своего раствора при разном значении рН, называемом интервалом перехода. У правильно подобранного индикатора интервал перехода совпадает с изменением рН в области точки эквивалентности, называемом скачком титрования. Для его определения необходимо построить кривые титрования, для чего проводят теоретические расчеты. В зависимости от силы кислоты и основания различают четыре типа кривых титрования.

Расчеты в титриметрическом анализе
Если точка эквивалентности верно определена, титрант и титруемое вещество прореагируют в эквивалентом количестве, то есть количество вещества титранта (nэ1) будет равно количеству титруемого вещества (nэ2): nэ1 = nэ2. Поскольку количество вещества эквивалента равно произведению молярной концентрации эквивалента и объема раствора, то верно равенство
Cэ1∙V1= Cэ2∙V2, где:
-Cэ1 – нормальная концентрация титранта, известная величина;
-V1 – объем раствора титранта, известная величина;
-Cэ2 – нормальная концентрация титруемого вещества, необходимо определить;
-V2 – объем раствора титруемого вещества, определяется в ходе титрования.
Проведя титрование, можно рассчитать концентрацию интересующего вещества по формуле:
Cэ2 = Cэ1∙V1/ V2
Выполнение титриметрического анализа
Методика количественного химического анализа титрованием включает этапы:
- Приготовление 0,1 н стандартного раствора из навески вещества.
- Приготовление приблизительно 0,1 н рабочего раствора.
- Стандартизация рабочего раствора по стандартному раствору.
- Титрование исследуемого раствора рабочим раствором.
- Проведение необходимых расчетов.



























