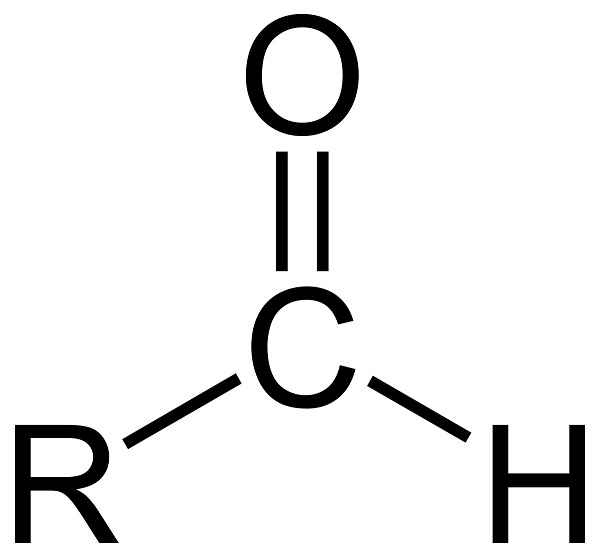
Альдегиды – органические вещества, которые содержат карбонильную группу >С=О, связанную хотя бы с одним атомом водорода. Альдегиды, а также схожие с ними по строению и свойствам кетоны, называют карбонильными, или оксосоединениями. Примеры альдегидов – муравьиный, уксусный, пропионовый альдегид.
Номенклатура
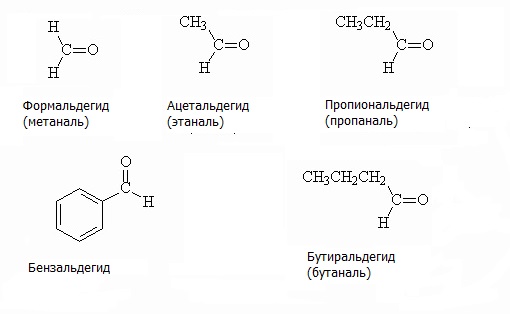
Тривиальные названия альдегидов образуют из тривиальных названий родственных карбоновых кислот. Примеры альдегидов с названиями представлены на рисунке. Первым представителем гомологического ряда альдегидов является муравьиный альдегид, или формальдегид, при окислении которого образуется муравьиная кислота. Второй представитель – уксусный альдегид, ацетальдегид, при окислении которого образуется уксусная кислота.
По номенклатуре ИЮПАК альдегидную группу обозначают суффиксом -аль, который добавляют к названию соответствующего углеводорода. Примеры альдегидов по номенклатуре ИЮПАК предложены на изображении ниже.
Если в соединении есть старшие группы, например, карбоксильные, то наличие альдегидной группы обозначают префиксом формил. Пример альдегида, который правильнее назвать дикарбоновой кислотой:
- НООС – СН (СНО) – СН2 – СООН
Это 2-формилбутандиовая кислота.
Описание веществ
Альдегиды в отличие от спиртов не обладают подвижным атомом водорода, поэтому их молекулы не ассоциируются, что объясняет значительно более низкие температуры кипения. К примеру, альдегид формальдегид кипит уже при температуре -21 °С, а спирт метанол – при +65 °С.
Однако такой низкой температурой кипения обладает только формальдегид, следующий представитель – ацетальдегид закипает при +21°С. Поэтому при комнатной температуре из всех альдегидов только формальдегид – газ, ацетальдегид уже легколетучая жидкость. Увеличение количества атомов углерода закономерно повышает температуру кипения. Так, бензальдегид С6Н5СНО закипает только при +180 °С. Разветвление цепи вызывает понижение температуры кипения.
Низшие альдегиды, к примеру, формальдегид, хорошо растворимы в воде. 40%-ный раствор формальдегида называют формалином, его часто используют для консервации биологических препаратов. Высшие альдегиды хорошо растворимы в органических растворителях – спирте, эфире.
Характерные запахи альдегидов
Альдегиды обладают характерными запахами, причем низшие – резкими, неприятными. Всем известен неприятный запах формалина – водного раствора формальдегида. У высших альдегидов цветочные запахи, их применяют в парфюмерии.
Примером альдегидов – веществ с приятным запахом - является ванилин, обладающий ароматом ванили, и бензальдегид, придающий характерный аромат миндальным орехам. Оба вещества получают синтетически и широко используют в качестве ароматизаторов в кондитерской промышленности и парфюмерии.
Получение
Рассмотрим способы получения альдегидов.
- Окисление спиртов.
Альдегиды получают при окислении первичных спиртов. Например, формальдегид, который используют в производстве полимерных материалов, лекарств, красителей, взрывчатых веществ. В промышленности формальдегид получают окислением кислородом метанола: 2СН3ОН + О2 = 2СН2О + 2Н2О.
Реакцию проводят на раскаленной серебряной сетке, серебро является катализатором. Через сетку пропускают пары метанола, смешанные с воздухом. Реакция идет с выделением большого количества тепла, которого хватает для поддержания сетки в раскаленном состоянии.
- Дегидрирование спиртов.
Альдегиды можно получать из спиртов и в отсутствии кислорода. В этом случае используют медный катализатор и высокие температуры (250 °С): R-CH2-OH = R-CHO + H2.
- Восстановление хлорангидридов кислот.
Альдегиды можно получать восстановлением водородом хлорангидридов кислот. В качестве катализатора используют «отравленный» палладий – с пониженной активностью: RCClO + H2 = RCHO + HCl.
- Получение ацетальдегида.
Ацетальдегид в промышленности получают окислением этилена кислородом или воздухом в жидкой фазе. В качестве катализатора необходим хлорид палладия (PdCl2): 2 СН2=СН2 + О2 = 2 СН3 СНО.
Химические свойства
Для альдегидов характерны следующие типы реакций:
- присоединения по карбонильной группе;
- полимеризации;
- конденсации;
- восстановления и окисления.
Большинство реакций идет по механизму нуклеофильного присоединения по связи С=О.
Обычно рассматривают химические свойства альдегидов на примере уксусного альдегида.
Реакции присоединения
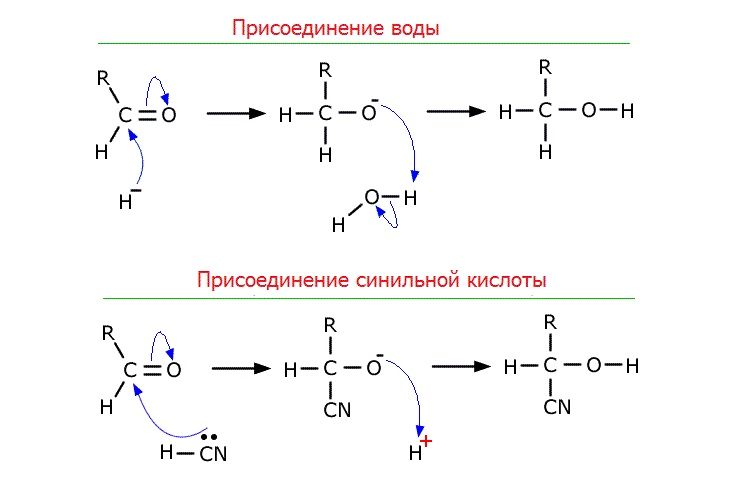
В карбонильной группе С=О электронная плотность смещена к атому кислорода, поэтому на карбонильном атоме углерода формируется частичный положительный заряд, который обусловливает химическую активность альдегидов. Положительный заряд на атоме углерода группы С=О обеспечивает его активность в реакциях с нуклеофильными реагентами – водой, спиртом, магний органическими соединениями. Атом кислорода воды может атаковать карбонильный атом углерода, присоединяться к нему и вызывать разрыв связи С=О.
Реакции конденсации
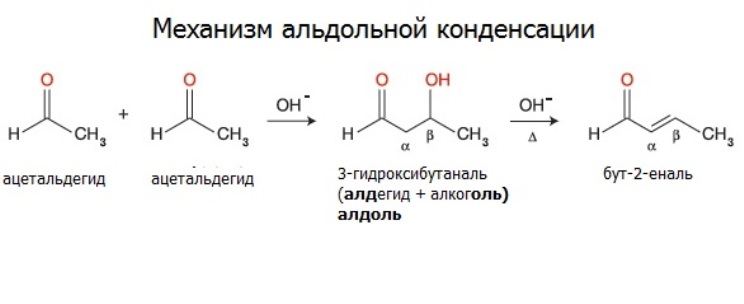
Альдегиды вступают в реакции альдольной и кротоновой конденсации.
Ацетальдегид при действии слабого раствора щелочи на холоду превращается в альдоль. Продуктом реакции является жидкость, смешивающаяся с водой при пониженном давлении. Это вещество содержит как альдегидную, так и спиртовую группу (отсюда и название).
Качественные реакции
Для выявления альдегидов можно использовать две качественные реакции:
- Реакция «серебряного зеркала». Реакция идет с реактивом Толленса – аммиачным раствором оксида серебра. При смешивании раствора аммиака и раствора нитрата серебра образуется сначала раствор гидроксида серебра, а при добавлении избытка аммиака - раствор гидроксида диамминсеребра (I), который и является окислителем. При взаимодействии с альдегидом выделяется элементное серебро в виде черного осадка. Если реакцию проводить при медленном нагревании, не тряся пробирку, серебро покроет стенки пробирки, создавая эффект «зеркала».

- Реакция «медного зеркала». Другим реактивом, открывающим альдегидную группу, является гидроксид меди (II). При взаимодействии с альдегидом он восстанавливается до оксида меди (I). Цвет меняется с синего сначала на оранжевый, затем на желтый. Если реакцию проводить при медленном нагревании, оксид будет образовывать тонкий оранжево-красный налет на стенках пробирки – «медное зеркало»: СН3СНО + 2 Cu(OH)2 + NaOH = CH3COONa + Cu2O↓ + 3H2O.



























