Открытие электрона в который уже раз поставило перед учеными всего мира вопрос: каково же внутренне строение атома? Естественно, что разглядеть даже в самый мощный микроскоп, как там все устроено, невозможно. Поэтому разные ученые предлагали свои версии внутренней структуры атома.
Так, Дж. Томпсон предложил модель, по которой атом целиком состоял из положительно заряженного вещества, внутри которого постоянно двигались отрицательно заряженные электроны. Параллельно с Томпсоном Ф. Ленард в начале ХХ века предположил, что внутри атома находится пустота, по которой перемещаются нейтральные частицы, состоящие из одинакового числа электронов и каких-то положительно заряженных элементов. В работах Ленарда эти частицы получили название динамиды.

Однако наиболее обстоятельной оказалась так называемая планетарная модель атома Резерфорда. По-настоящему знаменитым этого ученого сделала серия экспериментов над ураном, в результате которых было сформулировано и теоретически объяснено такое явление как радиоактивность.
Еще только задумываясь о том, что именно планетарная модель атома является истинным выражением структуры этого элемента, в своих первых крупных научных исследованиях Резерфорд пришел к выводу, что энергия, скрытая внутри атома, в несколько десятков тысяч раз превышает молекулярную энергию. От этого вывода он перешел к объяснению некоторых космических явлений, заявив, в частности, что солнечная энергия есть не что иное, как результат постоянных реакций, включающих в себя расщепление атома.
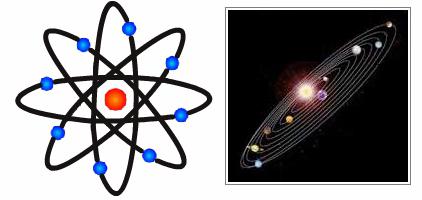
Важнейшим шагом к осмыслению структуры атома стали знаменитые опыты по движению альфа-частиц сквозь золотую фольгу: подавляющее число этих частиц проходило сквозь нее без всяких изменений, но отдельные элементы резко отклонялись от своего маршрута. Резерфорд предположил, что в этом случае эти частицы проходят рядом с одноименно заряженными элементами, размеры которых намного меньше размера атома. Так зародилась знаменитая планетарная модель строения атома. Это было большое достижение ученого.

Планетарная модель атома была предложена еще в самом начале двадцатого века Дж. Стони, однако у него она носила исключительно теоретический характер, в то время как Резерфорд пришел к ней через эксперименты, результаты которых были опубликованы в 1911 году в «Философском журнале».
Продолжая свои опыты, Резерфорд пришел к выводу, что количество альфа-частиц полностью соответствует порядковому номеру элемента в изданной совсем недавно периодической таблице Менделеева. Параллельно с этим датский ученый Нильс Бор, создавая свою теорию металлов, сделал важное открытие, касающееся орбит движения электронов, что стало одним из важнейших доказательств того, что именно планетарная модель атома наиболее приближена к действительному строению этой элементарной частицы. Мнения ученых совпали.
Таким образом, планетарная модель атома представляет собой теоретическое обоснование строения этой элементарной частицы, согласно которому в центре атома находится ядро с протонами, заряд которых имеет положительное значение, и электрически нейтральными нейтронами, а вокруг ядра, на значительном расстоянии от него, по орбитам движутся отрицательно заряженные электроны.





















