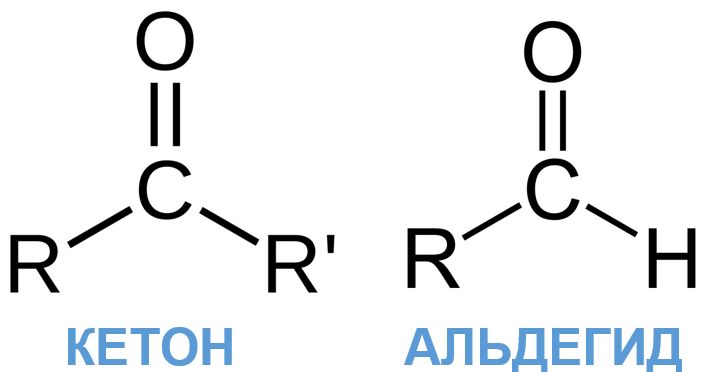
Альдегиды и кетоны имеют в своем составе карбонильную функциональную группу >С=О и относятся к классу карбонильных соединений. Также их называют оксосоединениями. Несмотря на то что эти вещества относятся к одному классу, из-за особенностей строения их все же разделяют на две большие группы.
В кетонах атом углерода из группы >С=О соединен с двумя одинаковыми или различными углеводородными радикалами, обычно они имеют вид: R-СО-R'. Такую форму карбонильной группы называют еще кетогруппой или оксогруппой. В альдегидах же карбонильный углерод соединен только с одним углеводородным радикалом, а оставшаяся валентность занимается атомом водорода: R-СОН. Такую группу принято называть альдегидной. Благодаря этим различиям в строении альдегиды и кетоны ведут себя немного по-разному при взаимодействии с одними и теми же веществами.
Карбонильная группа
Атомы С и О в этой группе находятся в sp2-гибридизированном состоянии. Углерод за счет sp2-гибридных орбиталей имеет 3 σ-связи, расположенные под углом примерно в 120 градусов в одной плоскости.
Атом кислорода обладает гораздо большей электроотрицательностью, чем углеродный атом, а поэтому стягивает на себя подвижные электроны π-связи в группе >С=О. Поэтому на атоме О возникает избыточная электронная плотность δ-, а на атоме С, напротив, происходит ее уменьшение δ+. Этим и объясняются особенности свойств альдегидов и кетонов.
Двойная связь С=О более прочная, чем С=С, но вместе с тем и более реакционно способная, что объясняется большой разницей в электроотрицательностях атомов углерода и кислорода.
Номенклатура
Как и для всех других классов органических соединений, существуют различные подходы к наименованию альдегидов и кетонов. В соответствии с положениями номенклатуры ИЮПАК, наличие альдегидной формы карбонильной группы обозначается суффиксом -аль, а кетонной -он. Если карбонильная группа является старшей, то она определяет порядок нумерации атомов С в основной цепи. В альдегидной карбонильный атом углерода является первым, а в кетонах атомы С нумеруют с того края цепи, к которому ближе группа >С=О. С этим связана необходимость обозначать положение карбонильной группы в кетонах. Делают это, записывая соответствующую цифру после суффикса -он.
| Н-СОН | метаналь | СН3-СО-СΗ3 | пропанон |
| СН3-СОН | этаналь | СН3-СО-СΗ2-СΗ3 | бутанон |
| СН3-СΗ2-СОΗ | пропаналь | СН3-СО-СΗ2-СН2-СΗ3 | пентанон-2 |
| СΗ3-СΗ2-СΗ2-СОΗ | бутаналь | СН3-СΗ2-СО-СΗ2-СН3 | пентанон-3 |
| СΗ3-(СΗ2)3-СОΗ | пентаналь | СН3-СО-СΗ2-СН2-СΗ2-СН3 | гексанон-2 |
| СΗ3-(СΗ2)4-СОН | гексаналь | СΗ3-СΗ2-СО-СН2-СΗ2-СН3 | гексанон-3 |
Если карбонильная группа не является старшей, то по правилам ИЮПАК ее наличие указывают приставкой -оксо для альдегидов и -оксо (-кето) для кетонов.
Для альдегидов широко применяют тривиальные названия, получаемые от наименования кислот, в которые они способны превращаться при окислении с заменой слова "кислота" на "альдегид":
- СΗ3-СОН уксусный альдегид;
- СΗ3-СН2-СОН пропионовый альдегид;
- СΗ3-СН2-СН2-СОН масляный альдегид.
Для кетонов распространены радикально функциональные названия, которые складываются из наименований левого и правого радикалов, соединенных с карбонильным атомом углерода, и слова "кетон":
- СΗ3-СО-СН3 диметилкетон;
- СΗ3-СΗ2-СО-СН2-СН2-СН3 этилпропилкетон;
- С6Η5-СО-СΗ2-СΗ2-СΗ3 пропилфенилкетон.
Классификация
В зависимости от характера углеводородных радикалов класс альдегидов и кетонов делят на:
- предельные - атомы С связаны друг с другом только одинарными связями (пропаналь, пентанон);
- непредельные - между атомами С имеются двойные и тройные связи (пропеналь, пентен-1-он-3);
- ароматические - содержат в своей молекуле бензольное кольцо (бензальдегид, ацетофенон).
По числу карбонильных и наличию других функциональных групп различают:
- монокарбонильные соединения - содержат только одну карбонильную группу (гексаналь, пропанон);
- дикарбонильные соединения - содержат две карбонильные группы в альдегидной и/или кетонной форме (глиоксаль, диацетил);
- карбонильные соединения, содержащие также другие функциональные группы, которые, в свою очередь, делятся на галогенкарбонильные, гидроксикарбонильные, аминокарбонильные и т.д.
Изомерия
Наиболее характерной для альдегидов и кетонов является структурная изомерия. Пространственная возможна тогда, когда в углеводородном радикале присутствует асимметрический атом, а также двойная связь с различными заместителями.
- Изомерия углеродного скелета. Наблюдается у обоих типов рассматриваемых карбонильных соединений, но начинается с бутаналя в альдегидах и с пентанона-2 в кетонах. Так, бутаналь СН3-СΗ2-СΗ2-СОН имеет один изомер 2-метилпропаналь СΗ3-СΗ(СΗ3)-СОН. А пентанон-2 СΗ3-СО-СΗ2-СΗ2-СΗ3 изомерен 3-метилбутанону-2 СΗ3-СО-СΗ(СΗ3)-СΗ3.
- Межклассовая изомерия. Оксосоединения с одинаковым составом изомерны между собой. Например, составу С3Η6О соответствуют пропаналь СН3-СΗ2-СОН и пропанон СΗ3-СО-СΗ3. А молекулярная формула альдегидов и кетонов С4Н8О подходит бутаналю СН3-СΗ2-СΗ2-СОН и бутанону СН3-СО-СΗ2-СΗ3.
Также межклассовыми изомерами для карбоксильных соединений являются циклические оксиды. Например, этаналь и этиленоксид, пропанон и пропиленоксид. Кроме того, непредельные спирты и простые эфиры также могут иметь общий состав и оксосоединениями. Так, молекулярную формулу С3Н6О имеют:
- СΗ3-СΗ2-СОН - пропаналь;
- СΗ2=СΗ-СΗ2-ОН - аллиловый спирт;
- СΗ2=СΗ-О-СН3 - метилвиниловый эфир.
Физические свойства
Несмотря на то что молекулы карбонильных веществ полярны, в отличие от спиртов, альдегиды и кетоны не имеют подвижного водорода, а значит, не образуют ассоциатов. Следовательно, температуры плавления и кипения их несколько ниже, чем у соответствующих им спиртов.
Если сравнивать альдегиды и того же состава кетоны, то у последних tкип несколько выше. С увеличением молекулярной массы tпл и tкип оксосоединений закономерно повышаются.

Низшие карбонильные соединения (ацетон, формальдегид, уксусный альдегид) хорошо растворимы в воде, высшие же альдегиды и кетоны растворяются в органических веществах (спиртах, эфирах и т.д.).
Пахнут оксосоединения весьма различно. Низшие их представители имеют резкие запахи. Альдегиды, содержащие от трех до шести атомов С, пахнут очень неприятно, а вот высшие их гомологи наделены цветочными ароматами и даже применяются в парфюмерии.
Реакции присоединения
Химические свойства альдегидов и кетонов обусловлены особенностями строения карбонильной группы. Из-за того, что двойная связь С=О сильно поляризована, то под действием полярных агентов она легко переходит в простую одинарную связь.
1. Взаимодействие с синильной кислотой. Присоединение HCN в присутствии следов щелочей происходит с образованием циангидринов. Щелочь добавляют для повышения концентрации ионов CN-:
R-СОН + NCN ―> R-СН(ОН)-CN
2. Присоединение водорода. Карбонильные соединения легко могут восстанавливаться до спиртов, присоединяя водород по двойной связи. При этом из альдегидов получают первичные спирты, а из кетонов - вторичные. Реакции катализируются никелем:
Н3С-СОН + Н2 ―> Н3С-СΗ2-ОΗ
Η3С-СО-СΗ3 + Η2 ―> Н3С-СΗ(ОΗ)-СΗ3
3. Присоединение гидроксиламинов. Эти реакции альдегидов и кетонов катализируются кислотами:
Н3С-СОН + NH2OH ―> Η3С-СΗ=N-ОН + Н2О
4. Гидратация. Присоединение молекул воды к оксосоединениям приводит к образованию гем-диолов, т.е. таких двухатомных спиртов, в которых две гидроксильные группы присоединены к одному атому углерода. Однако такие реакции обратимы, полученные вещества тут же распадаются с образованием исходных веществ. Электроноакцепторные группы в данном случае смещают равновесие реакций в сторону продуктов:
>С=О + Η2 <―> >С(ОΗ)2
5. Присоединение спиртов. В ходе этой реакции могут получаться различные продукты. Если к альдегиду присоединяется две молекулы спирта, то образуется ацеталь, а если только одна, то полуацеталь. Условием проведения реакции является нагревание смеси с кислотой или водоотнимающим агентом.
R-СОН + НО-R' ―> R-СН(НО)-О-R'
R-СОН + 2НО-R' ―> R-СН(О-R')2
Альдегиды с длинной углеводородной цепью склонны к внутримолекулярной конденсации, в результате которой образуются циклические ацетали.
Качественные реакции
Понятно, что при отличающейся карбонильной группе в альдегидах и кетонах химия их тоже различна. Порой необходимо понять, к какому из этих двух типов относится полученное оксосоединение. Альдегиды окисляются легче, чем кетоны, происходит это даже под действием оксида серебра или гидроксида меди (II). При этом карбонильная группа изменяется в карбоксильную и образуется карбоновая кислота.
Реакцией серебряного зеркала принято называть окисление альдегидов раствором оксида серебра в присутствии аммиака. Фактически в растворе образуется комплексное соединение, которое и воздействует на альдегидную группу:
Ag2O + 4NH3 + Н2О ―> 2[Ag(NΗ3)2]ОΗ
СΗ3-СОΗ + 2[Ag(NΗ3)2]ОΗ ―> СН3-СОО-NH4 + 2Ag + 3NH3 +Н2О
Чаще записывают суть происходящей реакции более простой схемой:
СΗ3-СОΗ + Ag2O ―> СΗ3-СООΗ + 2Ag
В ходе реакции окислитель восстанавливается до металлического серебра и выпадает в осадок. При этом на стенках реакционного сосуда образуется тонкий серебряный налет, похожий на зеркало. Именно за это реакция и получила свое название.

Еще одной качественной реакцией, указывающей на разницу в строении альдегидов и кетонов, является действие на группу -СОН свежим Cu(OΗ)2. Готовят его добавлением щелочей к растворам солей меди двухвалентной. При этом образуется голубая суспензия, которая при нагревании с альдегидами меняет окраску на красно-коричневую за счет образования оксида меди (I):
R-СОН + Cu(OΗ)2 ―> R-СООΗ + Cu2O + Η2О
Реакции окисления
Оксосоединения можно окислить раствором KMnO4 при нагревании в кислой среде. Однако кетоны при этом разрушаются с образованием смеси продуктов, которые не имеют практической ценности.
Химическая реакция, отражающая данное свойство альдегидов и кетонов, сопровождается обесцвечиванием розоватой реакционной смеси. При этом из подавляющего большинства альдегидов получаются карбоновые кислоты:
СН3-СОН + KMnO4 + H2SO4 ―> СН3-СОН + MnSO4 + K2SO4 + Н2О
Формальдегид в ходе данной реакции окисляется до муравьиной кислоты, которая под действием окислителей распадается с образованием углекислого газа:
Н-СОН + KMnO4 + H2SO4 ―> СО2 + MnSO4 + K2SO4 + Н2О
Для альдегидов и кетонов характерно полное окисление в ходе реакций горения. При этом образуются СО2 и вода. Уравнение горения формальдегида имеет вид:
НСОН + O2 ―> СО2 + Н2О

Получение
В зависимости от объемов продуктов и целей их использования способы получения альдегидов и кетонов делят на промышленные и лабораторные. В химическом производстве карбонильные соединения получают окислением алканов и алкенов (нефтепродуктов), дегидрированием первичных спиртов и гидролизом дигалогеналканов.
1. Получение формальдегида из метана (при нагревании до 500 °С в присутствии катализатора):
СΗ4 + О2 ―> НСОН + Η2О.
2. Окисление алкенов (в присутствии катализатора и высокой температуре):
2СΗ2=СΗ2 + О2 ―> 2СН3-СОН
2R-СΗ=СΗ2 + О2 ―> 2R-СΗ2-СОΗ

3. Отщепление водорода от первичных спиртов (катализируется медью, необходимо нагревание):
СΗ3-СΗ2-ОН ―> СН3-СОН + Η2
R-СН2-ОН ―> R-СОН + Н2
4. Гидролиз дигалогеналканов щелочами. Обязательным условием является присоединенность обоих атомов галогенов к одному и тому же атому углерода:
СΗ3-C(Cl)2H + 2NaOH ―> СΗ3-СОΗ + 2NaCl + Н2О
В небольших количествах в лабораторных условиях карбонильные соединения получают гидратацией алкинов или окислением первичных спиртов.
5. Присоединение воды к ацетиленам происходит в присутствии сульфида ртути в кислой среде (реакция Кучерова):
ΗС≡СΗ + Η2О ―> СН3-СОΗ
R-С≡СΗ + Η2О ―> R-СО-СН3
6. Окисление спиртов с концевой гидроксильной группой проводят с использованием металлических меди или серебра, оксида меди (II), а также перманганатом или дихроматом калия в кислой среде:
R-СΗ2-ОΗ + О2 ―> R-СОН + Н2О
Применение альдегидов и кетонов
Муравьиный альдегид необходим для получения фенолформальдегидных смол, получаемых в ходе реакции его конденсации с фенолом. В свою очередь образующиеся полимеры необходимы для производства разнообразных пластмасс, древесно-стружечных плит, клея, лаков и многого другого. Также он применяется для получения лекарственных средств (уротропина), дезинфицирующих средств и используется для хранения биологических препаратов.

Основная часть этаналя идет на синтез уксусной кислоты и других органических соединений. Некоторые количества ацетальдегида используют в фармацевтическом производстве.
Ацетон широко применяется для растворения многих органических соединений, в числе которых лаки и краски, некоторых видов каучуков, пластмасс, природных смол и масел. Для этих целей он используется не только чистым, но и в смеси с другими органическими соединениями в составе растворителей марок Р-648, Р-647, Р-5, Р-4 и др. Также его используют для обезжиривания поверхностей при изготовлении различных деталей и механизмов. Большие количества ацетона требуются для фармацевтического и органического синтеза.
Многие альдегиды обладают приятными ароматами, благодаря чему применяются в парфюмерной промышленности. Так, цитраль имеет лимонный запах, бензальдегид пахнет горьким миндалем, фенилуксусный альдегид привносит в композицию аромат гиацинта.

Циклогексанон нужен для производства многих синтетических волокон. Из него получают адипиновую кислоту, в свою очередь применяемую как сырье для капролактама, нейлона и капрона. Также он используется в качестве растворителя жиров, природных смол, воска и ПВХ.