Электрохимическая активность металлов имеет большое практическое значение. Знание ряда напряжений металлов позволяет предсказать возможность протекания окислительно-восстановительных реакций и лежит в основе целого ряда технологий. Давайте разберемся в устройстве этого фундаментального ряда.
История открытия
Первые представления об активности металлов появились еще в работах алхимиков в Средние века. Они описывали процессы взаимного вытеснения металлов как проявления трансмутации элементов.
"Исследование над явлениями вытеснения одних элементов другими" (Н.Н. Бекетов, 1859)
В 1798 году И.В. Риттер установил, что последовательность активности металлов эквивалентна ряду их окисления. А в 1860-х годах Н.Н. Бекетов детально изучил процессы взаимного вытеснения и дополнил новыми металлами.
Однако гипотеза Бекетова о связи активности металлов с их плотностью была опровергнута многочисленными экспериментальными данными конца XIX века. У. Одлинг описал множество случаев обращения активности.
Современные представления о ряде напряжений металлов сформировались в начале XX века в работах В. Нернста, который ввел понятие стандартного электродного потенциала.
Теоретические основы ряда напряжений
Ряд напряжения металлов - это последовательность расположения металлов по возрастанию значения их стандартного электродного потенциала. Этот потенциал характеризует способность металла ионизироваться с образованием катионов и восстанавливаться на электроде.
При измерении потенциалов используется стандартный водородный электрод, потенциал которого принимается за нуль.
- Активные металлы легко отдают электроны и стоят левее в ряду
- Пассивные металлы плохо восстанавливаются и находятся правее
На границе металл-раствор возникает двойной электрический слой. Его полярность определяет характер протекания процесса.
Положение в ряду зависит от энергии атомизации, суммарного потенциала ионизации и других факторов. Металлы в начале периодов активны и стоят левее. Элементы в середине периодов - правее.
| Цинк | Активный металл, легко отдает электроны |
| Медь | Менее активна, восстанавливает катионы |
Таким образом, цинк будет вытеснять медь из растворов ее солей. А медь не способна растворить цинк.
Таблица: ряд напряжения металлов

Ряд напряжений металлов: полный
Полный электрохимический ряд включает все элементы от самых сильных восстановителей до самых сильных окислителей (см. таблица: ряд напряжения металлов):
- Щелочные металлы (Li, Na, K)
- Щелочноземельные металлы (Mg, Ca, Sr)
- Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H
- Cu, Hg, Ag, Pd, Pt, Au
При этом положение водорода условно и зависит от кислотности среды. А благородные металлы являются наиболее пассивными.
Практическое применение ряда напряжений
Знание ряда напряжений металлов находит широкое применение на практике.
Прогнозирование коррозионных процессов
При контакте двух разных металлов более активный будет подвергаться коррозии. Поэтому нужно правильно подбирать материалы и защищать активные металлы покрытиями.
Гальванопокрытия
Нанесение тонких слоев металлов электролизом используется для декоративной отделки или придания специальных свойств. Например, хромирование, никелирование.
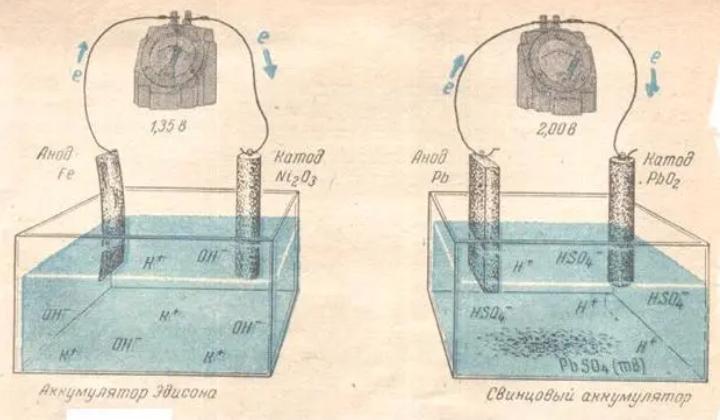
Принцип работы гальванических элементов
В химических источниках тока происходит окисление одного электродного материала и восстановление другого. Чем дальше расположены металлы в ряду напряжений, тем большее напряжение развивает элемент.
Определение стандартных электродных потенциалов
Существуют два основных метода измерения электродных потенциалов:
- Химический метод
- Электрохимический метод
При химическом методе фиксируется сам факт реакции и направление ее протекания. Электрохимический метод позволяет получить численные значения.
Рекомендации
- Использовать химически чистые вещества
- Тщательно контролировать температуру
- Проводить многократные повторные измерения
Обращение ряда напряжений металлов
В реальных условиях вследствие загрязнений, локальных дефектов и других причин возможны отклонения от стандартных значений электродных потенциалов.
Это может приводить к так называемому обращению ряда напряжений, когда более активные металлы ведут себя как пассивные и наоборот.
Факторы, влияющие на положение металла в ряду напряжений
На практике на величину электродного потенциала влияет множество факторов.
Концентрация раствора
С увеличением концентрации соли металла его потенциал смещается в сторону более положительных значений.
РН среды
В кислой среде некоторые металлы становятся более активными, чем в нейтральной или щелочной.
Температура
Повышение температуры приводит к увеличению скорости электродных реакций, что может влиять на потенциал.
Природа аниона
Анионы комплексообразователи (цианид-, галогенид-ионы) смещают потенциалы металлов в отрицательную область.
Поверхность электрода
На шероховатых или загрязненных поверхностях наблюдается отклонение от равновесного значения из-за затруднения протекания электродных реакций.
Расчет электродных потенциалов реальных систем
Для прогнозирования возможности протекания реакций необходимо учитывать конкретные условия и рассчитывать реальные значения потенциалов с помощью уравнения Нернста.
Пример расчета
Допустим, имеется система, состоящая из серебряного электрода, погруженного в 0,1 М раствор AgNO 3 при температуре 298 К. Необходимо рассчитать равновесный потенциал данной системы.
Перспективы использования ряда напряжений
Знание закономерностей ряда напряжений металлов позволяет целенаправленно подбирать материалы с нужными характеристиками для решения практических задач.
























