Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная масса, которую можно рассчитать для атомов, ионов и молекул. Один из важнейших элементов на Земле — кислород, с его участием протекают многие реакции и процессы. Для выполнения расчетов по формулам соединений, уравнениям реакций используется молярная масса кислорода, которая численно равна относительной массе его атома или молекулы.
Кислород
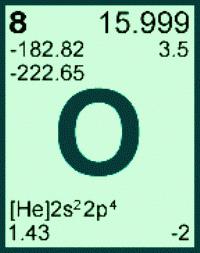
Общие сведения о кислороде (химическом элементе):
- латинское название — Oxygenium;
- химический символ — O;
- находится в верхней части 16-й группы (ранее — группы VI A) периодической таблицы;
- расположен во втором периоде сразу после азота, перед фтором;
- относится к семейству халькогенов;
- номер элемента в периодической таблице и заряд ядер его атомов — 8.
Кислород как один из компонентов атмосферы долгое время не могли выделить в чистом виде. Газ называли «животворящим», «эликсиром жизни». Честь открытия кислорода делят между собой ученые с мировым именем: К. Шееле, Дж. Пристли, А. Лавуазье. Термин «оксиген» предложил А. Лавуазье, исходя из важной роли вещества, его атомов в процессах образования оксидов и кислот.

Как находят молярную массу элемента или вещества?
При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.

Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
Молярная масса эквивалента кислорода
Эквивалентной называют величину, равную массе 1 моля атомов любого одновалентного элемента. В общем случае можно определить эквивалентную массу, поделив молярную массу атомов химического элемента на его валентность, найденную по формуле конкретного соединения. В большинстве своих соединений кислород, как химический элемент-халькоген, двухвалентен. Молярная масса кислорода может быть найдена по таблице Менделеева, ее округленное значение — 16. Эквивалентная масса в 2 раза меньше — 8. В химии применяется закон эквивалентов, который гласит, что вещества вступают в реакцию между собой в количествах, равных их эквивалентам. При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.

Кислород — один из важнейших элементов в земной коре, на него приходится 46,6 % массы. Простое соединение с тем же названием — второе по распространенности в атмосфере Земли. Содержание молекулярного кислорода в воздухе — 20,947 % по объему. При участии атомов элемента и молекул вещества протекают многие реакции и процессы в технике, промышленности, живой и неживой природе. Важно учесть количественные отношения в этих процессах, что значительно облегчает использование физических величин, в том числе молярной массы кислорода.



























