Коллоидная химия представляет собой науку о дисперсных системах и возникающих на границах раздела фаз поверхностных явлениях, и основной её теорией является коагуляция. Порог коагуляции зависит от многих факторов. Коллоидная химия помимо неё изучает адсорбцию, адгезию, смачивание и другие явления в дисперсных системах. Данная статья будет посвящена одному из разделов, который тем не менее тесно связан с остальными.

Коагуляция
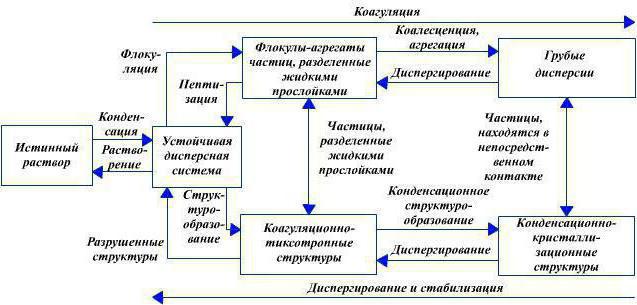
Что такое коагуляция? В переводе с латыни это свёртывание, сгущение, соединение мелких частиц в дисперсных системах и превращение их в более крупные в результате сцепления, процесс, относящийся в равной степени и к химии, и к физике. Так образуются коагуляционные структуры. Теория эта построена таким образом: существует дисперсная фаза, где частицы находятся в броуновском движении (независимо друг от друга) до той поры, когда две частицы не сблизятся на такое расстояние, при котором их центры можно определить как радиус сферы влияния (обозначается d).
Это расстояние примерно равно сумме радиусов частиц, и непосредственный контакт неизбежен, потому что внезапно (немедленным скачком) появляются силы взаимодействия, частицы притягиваются друг к другу и агрегируются. Вероятность столкновения более двух частиц ничтожно мала, а потому притягиваются либо одиночные, либо двойные с одиночной, либо двойные частицы друг с другом, тройные с одиночными и так далее. Отсюда начинается теория химических бимолекурярных реакций. Вот это и есть коагуляция. Порог коагуляции приводит к выпадению осадка в коллоидном растворе в виде флокул (хлопьев), либо получается студень.
Определение
Что такое коагуляция как процесс - выяснить удалось, теперь необходимо вывести определение. Коагуляция - это уменьшение степени дисперсности, а также числа частиц посредством слипания. Результатом является седиментация дисперсной фазы (то есть выпадение частиц) или любые изменения той дисперсной системы, которая была представлена изначально. Можно наблюдать в природе, как происходит самопроизвольная коагуляция. Это старение коллоидного раствора (золя) с расслаиванием на дисперсную среду и на твёрдую фазу с достижением минимальной энергии. Но человечество умеет с помощью коагулянтов (специальных реактивов) искусственно вызывать коагуляцию.
Порог коагуляции - меньшее количество электролита, достаточное для начала процесса выпадения осадка. Его структуры называются коагуляционными. Они образуются, если дисперсная система теряет седиментационную устойчивость. Достаточное содержание дисперсной фазы обеспечивает армирование полного объёма всей дисперсной системы. Однако "отвердеть" вся жидкая среда не может, коллоидная дисперсная фаза обычно очень мала, в несколько процентов от общей массы.
Свойства
Прочность коагуляционной структуры не слишком высока, механические воздействия вполне могут вызвать самопроизвольное восстановление в дисперсной подвижной среде. Такое свойство (тиксотропия) имеют полимеры, лаки, краски, где коагуляционные структуры образуются за счёт пигментов и наполнителей. Самым характерным примером могут служить пространственные сетки, которые возникают в дисперсиях глин при коагуляции их с помощью электролитов.
Седиментационная устойчивость - это противодействие оседанию частиц, которые достаточно тяжелы, но под воздействием силы тяжести не оседают. Это происходит во всех грубодисперсионных системах, что можно проследить на примерах осадка в суспензиях и сливок в эмульсиях, где происходит разделение на слой чистой дисперсионной среды и слой дисперсионной фазы. Для седиментации характерны две картины: медленное оседание и быстрое. В первом случае частицы не сцепляются, оседая по отдельности, а во втором - оседают совместно. Первый случай показывает седиментационную устойчивость, а второй - неустойчивость.
Проблема устойчивости
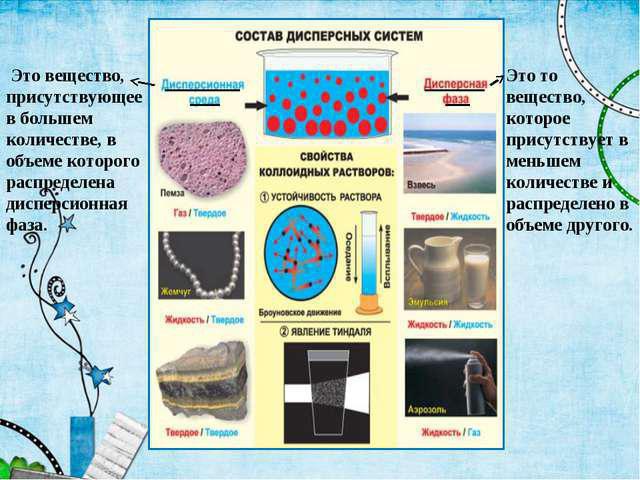
Все понимают под устойчивостью способность сохранять первоначальный состав в неизменности. Так же происходит и в процессах коагуляции. Порог коагуляции нарушает это состояние. Именно тогда кончается время постоянной концентрации дисперсной фазы и постоянного распределения в ней частиц. В коллоидной химии одна из центральных проблем - жизнь или смерть, которые выбирают для себя дисперсные системы. Это задачи противоположные, и их постоянно приходится решать практически. Например, сохранением или разрушением дисперсной системы.
Если это пищевая масса - необходимо сохранить её устойчивость, а если вода из любых водоёмов - устойчивость необходимо разрушить, очищая. То есть, вывести в осадок все нехорошие примеси. Или, например, нефти - их дисперсная фаза состоит из сложных надмолекулярных образований, которые выделяются в самостоятельную микрофазу как частицы самых разных размеров. И здесь дисперсные системы - это широчайшее поле деятельности.
Старение
Скорость старения коллоидного золя зависит от многих факторов: раздела фаз, коэффициента диффузии, радиуса частиц, растворимости и температуры макрофазы. Электрокоагуляция - ускорение старения, когда используется коагулирующая способность электролита. Столкновения частиц далеко не каждый раз вызывают слияние, поскольку их окружает двойной электрический слой, напротив, отталкивающий их друг от друга.
С помощью электролитов удаётся этот слой разрушить или деформировать, тем самым ускорив коалесценцию. Вид электролита, то есть лиотропные ряды ионов, валентность электролита влияют на эффективность этого процесса. Гидрофобные золи способны разрушаться, если электролиты добавлять понемногу. Это и стало объектом огромного числа теоретических и экспериментальных работ.
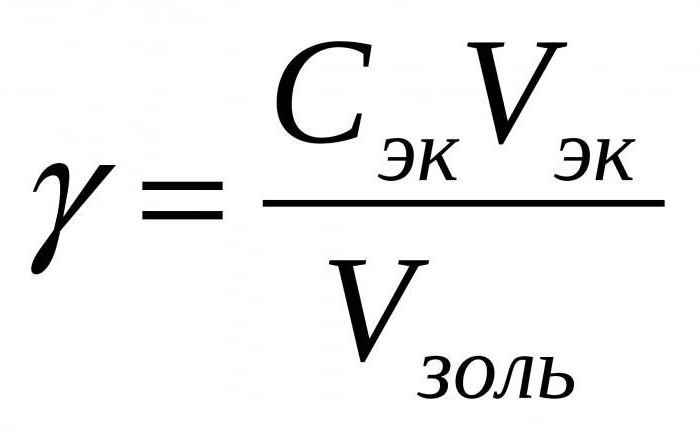
Ионы
Влияние электролитов на состояние гидрофобных золей показывает, что коагулирующее действие зависит от заряда ионов. Скорость коагуляции значительно повышается при концентрации электролита, которая превышает критическое значение (это порог коагуляции). Формула его рассчитывается, если известна концентрация коагулятора (электролита) - С, объём электролита, который добавляется - V, а также общий объём золя - V30 (обычно это десять миллиграммов). Величина, противостоящая порогу коагуляции, является коагулирующей способностью электролита, и чем ниже порог коагуляции, тем выше способность электролита к коагуляции.
Однако не весь электролит участвует в этом процессе, здесь главным действующим элементом является именно тот ион, совпадающий своим зарядом по знаку с зарядом противника (а заряд иона, призванного к коагулирующей деятельности, всегда противоположен заряду, который имеет коллоидная частица). Такой ион называется ионом-коагулянтом. И чем больше его заряд, тем выше коагулирующая способность, согласно правилу Шульце-Гарди. Связи между ионом-коагулянтом и порогом коагуляции описаны в теории Дерягина-Ландау. Правила электролитной коагуляции включают в себя и правило значности, касающееся соотношения порогов коагуляции для одновалентных, двухвалентных и трёхвалентных ионов. Y1 : Y2 : Y3 = 729 :11 : 1. Это означает, что трёхразрядный ион способен в 729 раз быстрее коагулировать, чем одноразрядный.
Поправки
С течением временем и в связи с развитием коллоидной химии как науки к правилу значности установлены некоторые отклонения. Порог коагуляции зависит не только от заряда, влияние оказывают и радиус иона-коагулянта, и способность к гидратации и абсорбции, а также сама природа иона, который коагулянту сопутствует. Многозарядность иона даёт эффект перезарядки частиц, то есть если знак заряда изменяется, изменяется и потенциал коллоидной частицы.
Добавляемые ионы обмениваются с противоионами, замещают их в адсорбционном и диффузном слоях. Если многозарядный ион мал, как, например, Al3+, Th4+ и другие, получается сверхэквивалентная адсорбция, когда этот ион замещает по заряду неэквивалентное количество прежних ионов на поверхности частиц. И тогда, например, вместо одного или двух ионов К+ оказывается ион Th4+. Это и показывает изменение потенциала и знака заряда.

Физика
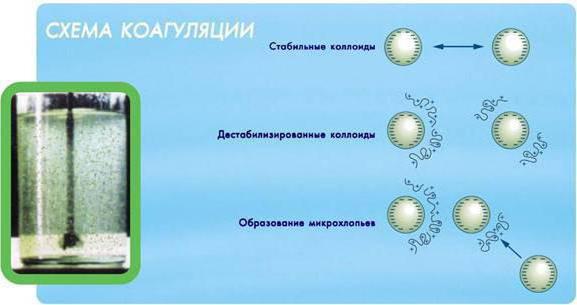
Коллоидная смесь стабильна, если ей помогают в этом электростатическое отталкивание и стерические эффекты. Именно поэтому коагулирование производится следующим методом: электростатическое отталкивание предотвращается посредством изменения кислотности или добавления солей, за счёт чего коллоидные частицы получают возможность сближаться до того расстояния, которое необходимо для их слипания.
Целью коагулирования является образование хлопьевидных скоплений, что необходимо, например, для отстаивания или фильтрования воды. Только если хлопья достигнут достаточно большого размера, их можно удалить. А без коагулирования делать это крайне непрактично, поскольку потребуется огромное количество времени. Оптимальный размер флокул для очистки воды, например, должен быть в несколько миллиметров, иначе примеси удалить практически невозможно.
Процесс
Коагулирование имеет два этапа:
1. Химикат быстро смешивается с водой - около одной минуты, чтобы коагулянт правильно распределился и не разрушил образовавшиеся флокулы. Обычно для смешивания используется специальный смеситель-резервуар.
2. От получаса до сорока пяти минут происходит собственно коагуляция, когда вода, проходя несколько резервуаров с уменьшающейся скоростью перемешивания, образует осадок.
Отдельный случай - когда коагуляция производится электролитами, где два гидрофобных золя имеют разные знаки зарядов. При обычной коагуляции перезарядкой занимаются ионы-коагулянты, а в данном случае нужно определённое соотношение концентрации смешиваемых золей, чтобы эта перезарядка наступила.
Значение
Взаимная коагуляция очень важна и в природных, и в технологических процессах. Например, формирование почвенного горизонта происходит благодаря коагуляции электролитами почвенных коллоидов. Соли в воде гидролизуются, образуя коллоидные частицы, положительно заряженные, - А1(ОН)3, которые взаимодействуют с коллоидными частицами в воде, заряженными почти всегда отрицательно, что и приводит к взаимной коагуляции, после чего коагулированные частицы выпадают в осадок.
Наиболее эффективна коагуляция, когда в дисперсную систему добавляют электролиты, содержащие ионы с противоположным зарядом, ликвидируя таким образом седиментационную устойчивость. Для процессов электролитной коагуляции используются соли железа или алюминия, а также их смеси. Коагуляцию можно вызвать самыми разными способами - от механического воздействия до изменения температуры. Если воду, например, вскипятить или выморозить, обязательно образуется осадок. Также влияют на коагуляционные процессы разнообразные излучения, добавление посторонних веществ, особенно электролитов. Именно электролитная коагуляция наиболее важна, а потому хорошо изучена и широко применяется.

Электролитная коагуляция
Как уже было сказано, электролитная коагуляция наиболее ярко происходит в коллоидных системах, где стабилизатор ионный, а устойчивость в высшей степени обеспечивает электростатическое отталкивание коллоидных частиц. Отсюда можно сделать вывод, что вместе с действием электролита уменьшается электростатическое отталкивание частиц, и частицы получают возможность слипаться.
Даже при не очень высокой концентрации электролитов коллоидные растворы начинают процесс коагуляции - медленной или быстрой. Но очень часто приходится создавать защиту устойчивости золей, создавая на поверхности частиц адсорбционные слои, у которых структурно-механические свойства повышены. Таким образом можно полностью остановить или предотвратить электролитную коагуляцию, просто добавив раствор высокомолекулярных соединений - казеинат натрия, желатин, яичный альбумин или что-то подобное.


























