Мир, в котором мы с вами живем, невообразимо прекрасен и полон множества различных процессов, которые задают течение жизни. Все эти процессы изучает всем знакомая наука - физика. Она дает возможность получить хоть какое-то представление о происхождении Вселенной. В данной статье мы рассмотрим такое понятие, как молекулярно-кинетическая теория, ее уравнения, виды и формулы. Однако, прежде чем перейти к более глубокому изучению этих вопросов, нужно прояснить для себя сам смысл физики и областей, ею изучаемых.
Что же такое физика?

На самом деле, это очень обширная наука и, пожалуй, одна из самых фундаментальных за всю историю человечества. Например, если та же информатика связана практически с каждой областью человеческой деятельности, будь то расчетное проектирование или создание мультфильмов, то физика - это сама жизнь, описание ее сложных процессов и течений. Давайте постараемся разобрать ее смысл, максимально упростив понимание.
Таким образом, физика - это наука, которая занимается изучением энергии и материи, связей между ними, объяснением многих процессов, происходящих в нашей необъятной Вселенной. Молекулярно-кинетическая теория строения вещества - лишь малая капля в море теорий и разделов физики.
Энергию, которую подробно изучает данная наука, можно представить в самых различных формах. Например, в виде света, движения, гравитации, излучения, электричества и во многих других видах. Нами будет затронута в данной статье молекулярная кинетическая теория строения этих форм.
Изучение материи дает нам представление об атомарном строении вещества. Оно, кстати, следует из молекулярно-кинетической теории. Наука о строении материи позволяет понять и найти смысл нашего существования, причины возникновения жизни и самой Вселенной. Давайте все-таки постараемся изучить молекулярно кинетическую теорию вещества.
Для начала необходимо некоторое вступление для полного осознания терминологии и каких-либо выводов.
Разделы физики
Отвечая на вопрос о том, что такое молекулярно-кинетическая теория, нельзя не поговорить о разделах физики. Каждый из этих них занимается подробным изучением и объяснением определенной области человеческой жизни. Они классифицируются следующим образом:
- Механика, которая делится еще на два раздела: кинематика и динамика.
- Статика.
- Термодинамика.
- Молекулярный раздел.
- Электродинамика.
- Оптика.
- Физика квантов и атомного ядра.
Поговорим конкретно о молекулярной физике, ведь именно в ее основе лежит молекулярно-кинетическая теория.
Что такое термодинамика?
Вообще, молекулярная часть и термодинамика являются тесно связанными разделами физики, которые занимаются изучением исключительно макроскопической составляющей общего числа физических систем. Стоит помнить, что эти науки описывают именно внутреннее состояние тел и веществ. Например, их состояние при нагреве, кристаллизации, парообразовании и конденсации, на атомарном уровне. Другими словами, молекулярная физика - наука о системах, которые состоят из огромного количества частиц: атомов и молекул.
Именно этими науками были изучены основные положения молекулярно-кинетической теории.
Еще в курсе седьмого класса мы познакомились с понятиями микро- и макромиров, систем. Не будет лишним освежить эти термины в памяти.
Микромир, как мы можем заметить из самого его названия, составляют элементарные частицы. Другими словами, это мир малых частиц. Размеры их измеряются в пределах от 10-18 м до 10-4 м, а время их фактического состояния может достичь как бесконечности, так и несоизмеримо малых промежутков, к примеру, 10-20 с.
Макромир рассматривает тела и системы устойчивых форм, состоящих из множества элементарных частиц. Такие системы соизмеримы с нашими, человеческими размерами.
Кроме того, существует и такое понятие, как мегамир. Его составляют огромных масштабов планеты, космические галактики и комплексы.
Основные положения теории
Теперь, когда мы немного повторили и вспомнили основные термины физики, можем перейти непосредственно к рассмотрению главной темы данной статьи.
Молекулярно-кинетическая теория появилась и была сформулирована впервые еще в девятнадцатом веке. Суть ее заключается в том, что она подробно описывает строение какого-либо вещества (чаще строение газов, чем твердых и жидких тел), основываясь на трех фундаментальных положениях, которые были собраны из предположений таких видных научных деятелей, как Роберт Гук, Исаак Ньютон, Даниил Бернулли, Михаил Ломоносов и многих других.
Положения основные молекулярно-кинетической теории звучат так:
- Абсолютно все вещества (независимо от того, жидкие они, твердые или газообразные) имеют сложное строение, состоящее из более мелких частиц: молекул и атомов. Атомы иногда называют "элементарными молекулами".
- Все эти элементарные частицы всегда находятся в состоянии непрерывного и хаотического перемещения. Каждый из нас сталкивался с прямым доказательством данного положения, но, вероятнее всего, не придавал этому особого значения. Например, все мы видели на фоне солнечных лучей, что пылинки непрерывно движутся в хаотическом направлении. Это связано с тем, что атомы производят взаимные толчки друг с другом, постоянно сообщая кинетическую энергию друг другу. Впервые это явление было изучено в 1827 году, а названо оно в честь открывателя - "броуновским движением".
- Все элементарные частицы находятся в процессе непрерывного взаимодействия друг с другом с определенными силами, которые имеют электрическую породу.
Стоит отметить, что другим примером, описывающим положение под номером два, которое может относиться также, например, к молекулярно кинетической теории газов, служит диффузия. С ней мы сталкиваемся и в повседневной жизни, и в многократных тестах и контрольных, поэтому важно иметь о ней представление.
Для начала рассмотрим следующие примеры:
Врач случайно пролил на стол спирт из колбы. Или же вы уронили флакон с духами, а они растеклись по полу.
Почему в этих двух случаях и запах спирта, и запах духов через какое то время наполнит всю комнату, а не только ту область, куда пролилось содержимое этих веществ?
Ответ прост: диффузия.
Диффузия - что это? Как она протекает?

Это процесс, при котором частицы, входящие в состав какого-то одного определенного вещества (чаще газа), проникают в межмолекулярные пустоты другого. В наших примерах, приведенных выше, произошло следующее: за счет теплового, то есть непрерывного и разобщенного движения, молекулы спирта и/или духов попадали в промежутки между молекулами воздуха. Постепенно, под действием соударения с атомами и молекулами воздуха, они распространялись по комнате. К слову, интенсивность диффузии, то есть скорость ее протекания, зависит от плотности веществ, участвующих в диффузии, а также от энергии движения их атомов и молекул, именуемой кинетической. Чем больше кинетическая энергия, тем выше скорость этих молекул, соответственно, и интенсивность.
Наиболее быстрым процессом диффузии можно назвать диффузию в газах. Это связано с тем, что газ не является однородным по своему составу, а это означает, что межмолекулярные пустоты в газах занимают значительный объем пространства, соответственно, и процесс попадания атомов и молекул стороннего вещества в них протекает проще и быстрее.
Немного медленней этот процесс проходит в жидкостях. Растворение кубиков сахара в кружке с чаем - как раз пример диффузии твердого тела в жидкости.
Но самой продолжительной по времени является диффузия в телах с твердой кристаллической структурой. Это именно так, потому что структура твердых тел однородна и имеет прочную кристаллическую решетку, в ячейках которой атомы твердого вещества колеблются. Например, если поверхности двух металлических брусков хорошо очистить, а затем заставить их контактировать друг с другом, то спустя достаточно длительное время мы сможем обнаружить кусочки одного металла в другом, и наоборот.
Как и любой другой фундаментальный раздел, основная теория физики подразделяется на отдельные части: классификацию, виды, формулы, уравнения и так далее. Таким образом, мы изучили основы молекулярно-кинетической теории. Это значит, что можно спокойно перейти к рассмотрению отдельных теоретических блоков.
Молекулярно-кинетическая теория газов
Появляется необходимость в понимании положений газовой теории. Как мы говорили ранее, нами будут рассмотрены макроскопические характеристики газов, например, давление и температура. Это понадобится в дальнейшем для того, чтобы вывести уравнение молекулярно-кинетической теории газов. Но математика - потом, а сейчас займемся теорией и, соответственно, физикой.
Учеными были сформулированы пять положений молекулярной теории газов, которые служат для осмысления кинетической модели газов. Они звучат так:
- Все газы состоят из элементарных частиц, которые не имеют какого-то определенного размера, но имеют определенную массу. Иными словами, объем этих частиц минимален по сравнению с величиной длины между ними.
- Атомы и молекулы газов практически не имеют потенциальной энергии, соответственно, по закону вся энергия равна кинетической.
- С этим положением мы уже знакомились ранее - броуновское движение. То есть, газовые частицы всегда совершают в непрерывное и сумбурное движение.
- Абсолютно все взаимные соударения газовых частиц, сопровождающиеся сообщением скорости и энергии, являются полностью эластичными. Это означает, что потери энергии или резкие скачки их кинетической энергии при столкновении отсутствуют.
- При нормальных условиях и постоянной температуре усредненная энергия движения частиц практически всех газов одинакова.
Пятое положение мы с вами можем переписать через такой вид уравнения молекулярно-кинетической теории газов:
Е=1/2*m*v^2=3/2*k*T,
где k - это постоянная Больцмана; Т - температура в Кельвинах.
Это уравнение дает нам понять связь между скоростью элементарных частиц газа и их абсолютной температурой. Соответственно, чем выше их абсолютная температура, тем больше их скорость и кинетическая энергия.
Давление газов
Такие макроскопические составляющие характеристики, как, например, давление газов, также можно объяснить с помощью кинетической теории. Для этого представим такой пример.
Допустим, что молекула какого-то газа находится в ящике, длина которого L. Воспользуемся вышеописанными положениями газовой теории и учтем тот факт, что молекулярная сфера движется только по иксовой оси. Таким образом, мы сможем наблюдать процесс упругого столкновения с одной из стенок сосуда (ящика).
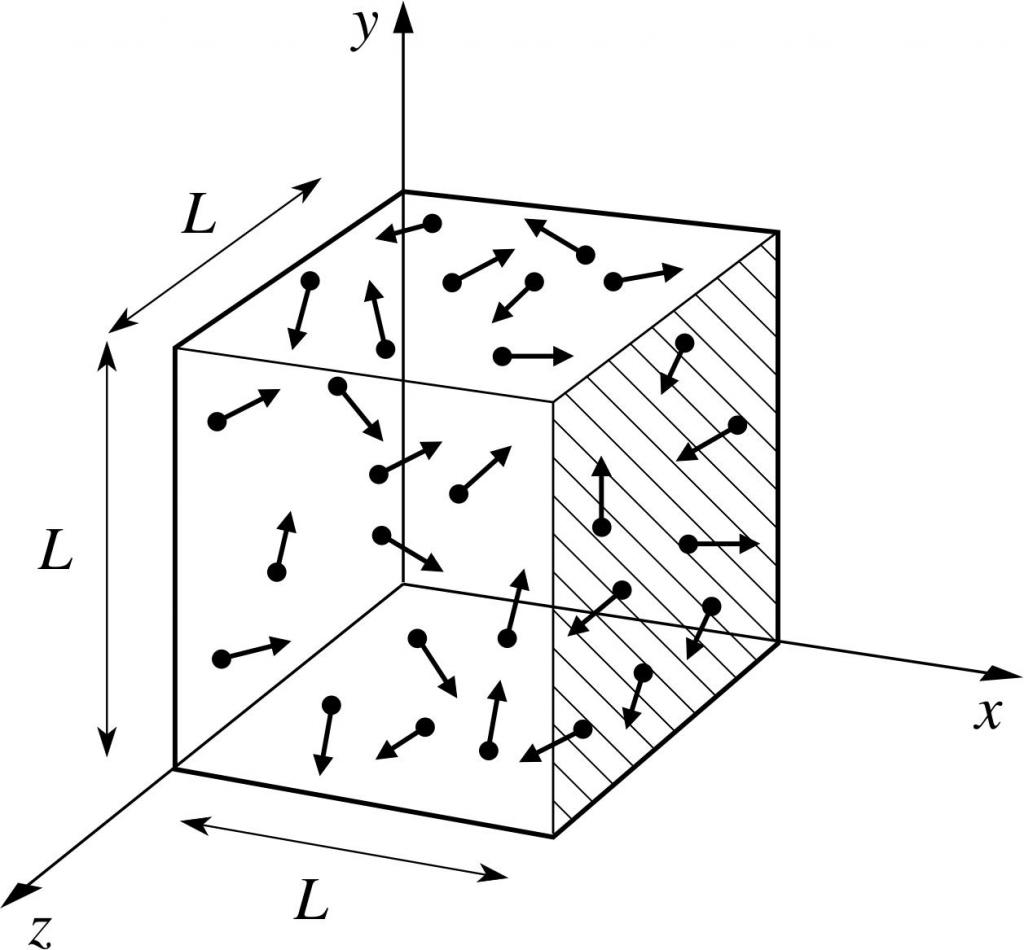
Импульс происходящего столкновения, как нам известно, определяется формулой: p=m*v, но в данном случае эта формула приобретет проекционный вид: p=m*v(х).
Так как нами рассматривается только размерность оси абсцисс, то есть оси х, то общее изменение импульса будет выражено формулой: m*v(х) - m*(-v(х))=2*m*v(х).
Далее рассмотрим силу, оказываемую нашим объектом с помощью второго закона Ньютона: F=m*a=P/t.
Из этих формул выразим давление со стороны газа: P=F/a;
Теперь подставим в полученную формулу выражения силы и получим: P=m*v(х)^2/L^3.
После этого нашу готовую формулу давления можно записать для N-го числа молекул газа. Иными словами, она приобретет следующий вид:
P=N*m*v(х)^2/V, где v - скорость, а V - объем.
Теперь постараемся выделить несколько основных положений по давлению газа:
- Оно проявляется благодаря столкновениям молекул с молекулами стенок объекта, в котором он находится.
- Величина давления прямо пропорциональна силе и скорости ударения молекул о стенки сосуда.
Немного кратких выводов по теории
Прежде чем пойти дальше и рассмотреть основное уравнение молекулярно-кинетической теории, мы предлагаем вам несколько кратких выводов из вышеописанных пунктов и теории:
- Мерой средней энергии движения ее атомов и молекул является абсолютная температура.
- В том случае, когда два различных газа находятся при тождественной температуре, их молекулы имеют равную среднюю кинетическую энергию.
- Энергия газовых частиц прямо пропорциональна среднеквадратичной скорости: Е=1/2*m*v^2.
- Хотя молекулы газа и имеют среднюю кинетическую энергию, соответственно, и среднюю скорость, отдельные частицы движутся с различной скоростью: какие-то быстро, какие-то медленно.
- Чем выше температура, тем выше и скорость молекул.
- Во сколько раз мы увеличиваем температуру газа (например, удваиваем), во столько раз увеличивается и энергия движения его частиц (соответственно, удваивается).
Основное уравнение и формулы

Основное уравнение молекулярно-кинетической теории позволяет установить взаимосвязь между величинами микромира и, соответственно, макроскопическими, то есть измеряемыми, величинами.
Одной из самых простых моделей, которые может рассматривать молекулярная теория, считается модель идеального газа.
Можно сказать, что это своеобразная воображаемая модель, изучаемая молекулярно-кинетической теорией идеального газа, в которой:
- простейшие частицы газа рассматриваются в качестве идеально упругих шаров, которые проявляют взаимодействие как друг с другом, так и с молекулами стенок какого бы то ни было сосуда только в одном случае - абсолютно упругого столкновения;
- силы притяжения внутри газа отсутствуют, или можно ими фактически пренебречь;
- элементы внутреннего строения газа могут приниматься в качестве материальных точек, то есть их объемом можно также пренебречь.
Рассматривая такую модель, физик Рудольф Клаузиус немецкого происхождения написал формулу давления газа через связь микро- и макроскопических параметров. Она имеет вид:
р=1/3*m(0)*n*v^2.
Позже эту формулу назовут как основное уравнение молекулярно-кинетической теории идеального газа. Ее можно будет представить в нескольких различных видах. Наша обязанность сейчас заключается в том, чтобы показать разделы, такие как молекулярная физика, молекулярно-кинетическая теория, а значит и их полные уравнения и виды. Поэтому есть смыл в рассмотрении иных вариаций основной формулы.
Нам известно, что среднюю энергию, характеризующую движение молекул газа, можно найти с помощью формулы: Е=m(0)*v^2/2.
В таком случае мы можем заменить выражение m(0)*v^2 в исходной формуле давления на среднюю кинетическую энергию. В результате этого нам представится возможность составить основное уравнение молекулярно-кинетической теории газов в такой форме: р=2/3*n*E.
Кроме того, мы с вами знаем, что выражение m(0)*n можно расписать в виде произведения двух частных:
m/N*N/V=m/V=ρ.
После этих манипуляций мы можем переписать нашу формулу уравнения молекулярно-кинетической теории идеального газа уже в третьем, отличном от других, виде:
р=1/3*ρ*v^2.
Ну что, пожалуй, это все, что нужно знать по данной теме. Осталось только систематизировать полученные знания в форме кратких (и не очень) выводов.
Все общие выводы и формулы по теме "Молекулярно-кинетическая теория"
Итак, приступим.
Во-первых:
Физика - фундаментальная наука, входящая в курс естествознания, которая занимается тем, что изучает свойства материи и энергии, их строения, закономерностей неорганической природы.
В ее состав входят следующие разделы:
- механика (кинематика и динамика);
- статика;
- термодинамика;
- электродинамика;
- молекулярный раздел;
- оптика;
- физика квантов и атомного ядра.
Во-вторых:
Физика простых частиц и термодинамика являются тесно связанными разделами, которые занимаются изучением исключительно макроскопической составляющей общего числа физических систем, то есть систем, состоящих из огромного числа элементарных частиц.
В их основе лежит молекулярно-кинетическая теория.
В-третьих:
Суть вопроса заключается в следующем. Молекулярно-кинетическая теория подробно описывает строение какого-либо вещества (чаще строение газов, чем твердых и жидких тел), основываясь на трех фундаментальных положениях, которые были собраны из предположений видных научных деятелей. Среди них: Роберт Гук, Исаак Ньютон, Даниил Бернулли, Михаил Ломоносов и многие другие.
В-четвертых:
Три основных положения молекулярно-кинетической теории:
- Все вещества (независимо от того, жидкие они, твердые или газообразные) имеют сложное строение, состоящее из более мелких частиц: молекул и атомов.
- Все эти простые частицы находятся в непрерывном сумбурном движении. Пример: броуновское движение и диффузия.
- Все молекулы при любых условиях взаимодействуют друг с другом с определенными силами, которые имеют электрическую породу.
Каждое это положение молекулярно-кинетической теории является прочным фундаментом в изучении строения материи.
В-пятых:
Несколько главных положений молекулярной теории для модели газа:
- Все газы состоят из элементарных частиц, которые не имеют какого-то определенного размера, но имеют определенную массу. Иными словами, объем этих частиц минимален по сравнению с расстояниями между ними.
- Атомы и молекулы газов практически не имеют потенциальной энергии, соответственно, их полная энергия равна кинетической.
- С этим положением мы уже знакомились ранее - броуновское движение. То есть, газовые частицы всегда находятся в непрерывном и беспорядочном движении.
- Абсолютно все взаимные соударения атомов и молекул газов, сопровождающиеся сообщением скорости и энергии, являются полностью эластичными. Это означает, что потери энергии или резкие скачки их кинетической энергии при столкновении отсутствуют.
- При нормальных условиях и постоянной температуре средняя кинетическая энергия практически всех газов одинакова.
В-шестых:
Выводы из теории по газам:
- Абсолютная температура является мерой средней кинетической энергии ее атомов и молекул.
- В том случае, когда два различных газа находятся при одинаковой температуре, их молекулы имеют одинаковую среднюю кинетическую энергию.
- Средняя кинетическая энергия частиц газа прямо пропорциональна среднеквадратичной скорости: Е=1/2*m*v^2.
- Хотя молекулы газа и имеют среднюю кинетическую энергию, соответственно, и среднюю скорость, отдельные частицы движутся с различной скоростью: какие-то быстро, какие-то медленно.
- Чем выше температура, тем выше и скорость молекул.
- Во сколько раз мы увеличиваем температуру газа (например, удваиваем), во столько раз увеличивается и средняя кинетическая энергия его частиц (соответственно, удваивается).
- Взаимосвязь между давлением газа на стенки сосуда, в котором он располагается, и интенсивностью ударов молекул об эти стенки прямо пропорциональна: чем больше ударов, тем выше давление, и наоборот.
В-седьмых:
Модель идеального газа - такая модель, в которой должны выполняться следующие условия:
- Молекулы газа могут и рассматриваются в качестве идеально упругих шаров.
- Эти шары могут взаимодействовать друг с другом и со стенками какого бы то ни было сосуда только в одном случае - абсолютно упругого столкновения.
- Те силы, которые описывают взаимную тягу между атомами и молекулами газа, отсутствуют или можно ими фактически пренебречь.
- Атомы и молекулы рассматриваются в качестве материальных точек, то есть их объемом можно также пренебречь.
В-восьмых:
Приведем все основные уравнения и покажем в теме "Молекулярно-кинетическая теория" формулы:
р=1/3*m(0)*n*v^2 - основное уравнение для модели идеального газа, выведена немецким физиком Рудольфом Клаузиусом.
р=2/3*n*E - основное уравнение молекулярно-кинетической теории идеального газа. Выводится через среднюю кинетическую энергию молекул.
р=1/3*ρ*v^2 - это же уравнение, но рассмотренное через плотность и среднюю квадратичную скорость молекул идеального газа.
m(0)=M/N(a) - формула для нахождения массы одной молекулы через число Авогадро.
v^2=(v(1)+v(2)+v(3)+...)/N - формула для нахождения средней квадратичной скорости молекул, где v(1),v(2),v(3) и так далее - скорости первой молекулы, второй, третьей и так далее до n-ной молекулы.
n=N/V - формула для нахождения концентрации молекул, где N - количество молекул в объеме газа к данному объему V.
Е=m*v^2/2=3/2*k*Т - формулы для нахождения средней кинетической энергии молекул, где v^2 - средняя квадратичная скорость молекул, k - постоянная величина, названная в честь австрийского физика Людвига Больцмана, а Т - это температура газа.
p=nkT - формула давления через концентрацию, постоянную Больцмана и абсолютную температуру Т. Из нее вытекает другая фундаментальная формула, открытая русским ученым Менделеевым и французским физиком-инженером Клайпероном:
pV=m/M*R*T, где R=k*N(a) - универсальная постоянная для газов.
Теперь покажем константы для разных изо-процессов: изобарного, изохорного, изотермического и адиабатного.
р*V/Т=const - выполняется в том случае, когда масса и состав газа являются величинами неизменными.
р*V=const - если при этом постоянна и температура.
V/T=const - если постоянно давление газа.
p/T=const - если объем постоянен.
Пожалуй, вот и все, что нужно было бы знать по этой теме.
Сегодня мы с вами погрузились в такую научную область, как теоретическая физика, ее множественные разделы и блоки. Более подробно нами была затронута такая область физики, как фундаментальная молекулярная физика и термодинамика, а именно молекулярно-кинетическая теория, которая, казалось бы, не представляет никаких сложностей при первичном изучении, но на самом деле имеет множество подводных камней. Она расширяет наше представление о модели идеального газа, которую мы также подробно изучили. Кроме того, стоит отметить, что мы познакомились и с основными уравнениями молекулярной теории в различных их вариациях, а также рассмотрели все самые необходимые формулы для нахождения тех или иных неизвестных величин по этой теме Это будет особо полезно при подготовке к написанию каких-либо тестов, экзаменационных и контрольных работ, или для расширения общего кругозора и знаний по физике.
Надеемся, что данная статья была вам полезна, и вы извлекли из нее только самую необходимую информацию, укрепив свои знания в таких столпах термодинамики, как основные положения молекулярно-кинетической теории.



























