Узнаем сегодня, как определить полярность связи и зачем это нужно. Раскроем физический смысл рассматриваемой величины.
Химия и физика

Когда-то все дисциплины, посвященные изучению окружающего мира, объединялись одним определением. И астрономы, и алхимики, и биологи были философами. Но сейчас существует строгое распределение по разделам науки, а большие университеты точно знают, что нужно знать математикам, а что – лингвистам. Впрочем, в случае химии и физики четкой границы нет. Часто они взаимно проникают друг в друга, а бывает, что идут параллельными курсами. В частности, спорным объектом является полярность связи. Как определить, относится эта область знания к физике или химии? По формальному признаку – ко второй науке: сейчас школьники изучают это понятие как часть химии, но без знаний по физике им не обойтись.
Строение атома

Для того чтобы понять, как определить полярность связи, сначала надо вспомнить, как устроен атом. В конце девятнадцатого века было известно, что любой атом нейтрален в целом, но содержит в разных обстоятельствах разные заряды. Резерфод установил, что в центре любого атома располагается тяжелое и положительно заряженное ядро. Заряд атомного ядра всегда целочисленный, то есть он составляет +1, +2 и так далее. Вокруг ядра располагается соответствующее количество легких отрицательно заряженных электронов, число которых строго соответствует заряду ядра. То есть если заряд ядра +32, то вокруг него должны располагаться тридцать два электрона. Они занимают определенные позиции вокруг ядра. Каждый электрон как бы «размазан» вокруг ядра на своей орбитали. Ее форма, позиция и расстояние до ядра определяются четырьмя квантовыми числами.
Почему возникает полярность

В нейтральном атоме, расположенном вдалеке от других частиц (например, в глубоком космосе, вне галактики), все орбитали симметричны относительно центра. Несмотря на довольно сложную форму некоторых из них, орбитали любых двух электронов не пересекаются в одном атоме. Но если наш отдельно взятый атом в вакууме встретит на своем пути другой (например, войдет в облако газа), то он захочет взаимодействовать с ним: орбитали валентных внешних электронов вытянутся в сторону соседнего атома, сольются с ним. Возникнет общее электронное облако, новое химическое соединение и, следовательно, полярность связи. Как определить, какой атом возьмет себе большую часть общего электронного облака, расскажем далее.
Какими бывают химические связи

В зависимости от типа взаимодействующих молекул, разности в зарядах их ядер и силы возникающего притяжения, существуют следующие типы химических связей:
- одноэлектронная;
- металлическая;
- ковалентная;
- ионная;
- ван-дер-ваальсова;
- водородная;
- двухэлектронная трёхцентровая.
Для того чтобы задаваться вопросом о том, как определить полярность связи в соединении, она должна быть ковалентной или ионной (как, например, у соли NaCl). В целом эти два типа связи различаются только тем, насколько сильно смещается электронное облако в сторону одного из атомов. Если ковалентная связь не образована двумя одинаковыми атомами (например, О2), то она всегда слегка поляризована. В ионной связи смещение сильнее. Считается, что ионная связь приводит к образованию ионов, так как один из атомов «забирает» электроны другого.
Но на самом деле полностью полярных соединений не существует: просто один ион очень сильно притягивает к себе общее электронное облако. Настолько сильно, что оставшимся кусочком равновесия можно пренебречь. Итак, надеемся, стало понятно, что определить полярность ковалентной связи можно, а полярность ионной связи не имеет смысла определять. Хотя в данном случае различие между этими двумя типами связи – это приближение, модель, а не истинное физическое явление.
Определение полярности связи
Надеемся, читатель уже понял, что полярность химической связи – это отклонение распределения в пространстве общего электронного облака от равновесного. А равновесное распределение существует в изолированном атоме.
Способы измерения полярности

Как определить полярность связи? Вопрос этот далеко не однозначный. Для начала надо сказать, что раз симметрия электронного облака поляризованного атома отличается от аналогичной нейтрального, то и рентгеновский спектр изменится. Таким образом, смещение линий в спектре даст представление о том, какова полярность связи. А если требуется понять, как определить полярность связи в молекуле более точно, то надо знать не только спектр испускания или поглощения. Требуется выяснить:
- размеры участвующих в связи атомов;
- заряды их ядер;
- какие связи были созданы у атома до возникновения этой;
- какова структура всего вещества;
- если структура кристаллическая, какие в ней существуют дефекты и как они влияют на все вещество.
Полярность связи обозначается как верхний знак следующего вида: 0,17+ или 0,3-. Стоит также помнить, что один и тот же вид атомов будет иметь непохожую полярность связи в соединении с различными веществами. Например, в оксиде BeO у кислорода полярность 0,35-, а в MgO – 0,42-.
Полярность атома
Читатель может задать и такой вопрос: "Как определить полярность химической связи, если факторов так много?" Ответ одновременно и прост, и сложен. Количественные меры полярности определяются как эффективные заряды атома. Эта величина является разностью между зарядом находящегося в определенной области электрона и соответствующей области ядра. В целом эта величина достаточно хорошо показывает некую асимметричность электронного облака, которая возникает при образовании химической связи. Сложность состоит в том, что определить, какая именно область нахождения электрона принадлежит именно этой связи (особенно в сложных молекулах) почти что невозможно. Так что, как и в случае разделения химических связей на ионные и ковалентные, ученые прибегают к упрощениям и моделям. При этом отбрасываются те факторы и значения, которые влияют на результат незначительно.
Физический смысл полярности соединения

Каков же физический смысл значения полярности связи? Рассмотрим один пример. Атом водорода H входит как во фтороводородную кислоту (HF), так и в соляную (HCl). Его полярность в HF равна 0,40+, в HCl – 0,18+. Это значит, что общее электронное облако гораздо сильнее отклоняется в сторону фтора, чем в сторону хлора. И значит, что электроотрицательность атома фтора намного сильнее электроотрицательности атома хлора.
Полярность атома в молекуле
Но вдумчивый читатель вспомнит, что, помимо простых соединений, в которых присутствуют два атома, существуют и более сложные. Например, чтобы образовать одну молекулу серной кислоты (H2SO4), требуется два атома водорода, один – серы, и целых четыре кислорода. Тогда возникает другой вопрос: как определить наибольшую полярность связи в молекуле? Для начала надо помнить, что любое соединение имеет некоторую структуру. То есть серная кислота – это не нагромождение всех атомов в одну большую кучу, а некая структура. К центральному атому серы присоединяются четыре атома кислорода, образуя подобие креста. С двух противоположных сторон атомы кислорода присоединяются к сере двойными связями. С двух остальных сторон атомы кислорода присоединяются к сере одинарными связями и «держат» с другой стороны по водороду. Таким образом, в молекуле серной кислоты существуют следующие связи:
- O-H;
- S-O;
- S=O.
Определив по справочнику полярность каждой из этих связей, можно найти наибольшую. Однако стоит помнить, что если в конце длинной цепочки атомов стоит сильно электроотрицательный элемент, то он может «перетягивать» на себя электронные облака соседних связей, повышая их полярность. В более сложной, чем цепочка, структуре вполне возможны иные эффекты.
Чем полярность молекулы отличается от полярности связи?
Как определить полярность связи, мы рассказали. В чем состоит физический смысл понятия, мы раскрыли. Но эти слова встречаются и в других словосочетаниях, которые относятся к данному разделу химии. Наверняка читателей интересует, каким образом взаимодействуют химические связи и полярность молекул. Отвечаем: эти понятия взаимно дополняют друг друга и невозможны по отдельности. Это мы продемонстрируем на классическом примере воды.
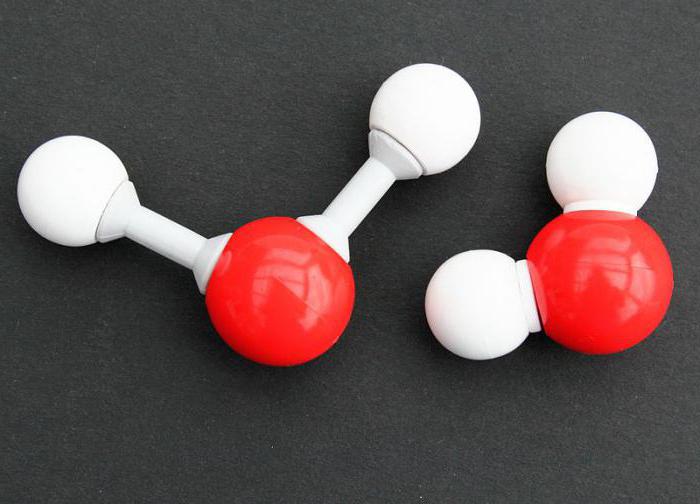
В молекуле H2O две одинаковые связи H-O. Между ними угол в 104,45 градуса. Так что структура молекулы воды представляет собой нечто вроде двузубой вилки с водородами на концах. Кислород – это более электроотрицательный атом, он оттягивает на себя электронные облака двух водородов. Таким образом, при общей электронейтральности, зубчики вилки получаются немного более положительными, а основание – немного более отрицательным. Упрощение приводит к тому, что молекула воды имеет полюса. Это и называется полярностью молекулы. Поэтому вода - такой хороший растворитель, эта разница в зарядах позволяет молекулам чуть-чуть оттягивать на себя электронные облака других веществ, разъединяя кристаллы на молекулы, а молекулы – на атомы.
Чтобы понять, почему у молекул при отсутствии заряда существует полярность, надо помнить: важна не только химическая формула вещества, но и строение молекулы, виды и типы связей, которые в ней возникают, разница в электроотрицательности входящих в нее атомов.
Наведенная или вынужденная полярность
Помимо собственной полярности, существует еще и наведенная или вызванная факторами извне. Если на молекулу действует внешнее электромагнитное поле, которое значительнее существующих внутри молекулы сил, то оно способно изменить конфигурацию электронных облаков. То есть если молекула кислорода тянет на себя облака водорода в H2O, и внешнее поле сонаправлено с этим действием, то поляризация усиливается. Если поле как бы мешает кислороду, то полярность связи немного уменьшается. Надо отметить, что требуется приложить достаточно большое усилие, чтобы как-то повлиять на полярность молекул, и еще большее – чтобы повлиять на полярность химической связи. Достигается этот эффект только в лабораториях и космических процессах. Обычная микроволновка лишь усиливает амплитуду колебаний атомов воды и жиров. Но это никак не влияет на полярность связи.
В каком случае имеет смысл направление полярности
В связи с термином, который рассматривается нами, нельзя не упомянуть, что такое прямая и обратная полярность. Если речь идет о молекулах, то полярность имеет знак «плюс» или «минус». Это значит, что атом либо отдает свое электронное облако и таким образом становится чуть более положительным, либо, наоборот, тянет облако на себя и приобретает отрицательный заряд. А направление полярности имеет смысл только тогда, когда заряд движется, то есть когда по проводнику идет ток. Как известно, электроны движутся от их источника (отрицательно заряженного) к месту притяжения (положительно заряженного). Стоит напомнить, что существует теория, согласно которой электроны на самом деле движутся в обратную сторону: от положительного источника к отрицательному. Но в целом это не имеет значения, важен лишь факт их движения. Так вот, в некоторых процессах, например при сварке металлических частей, важно, куда именно присоединены какие полюса. Следовательно, важно знать, как подключена полярность: напрямую или в обратную сторону. В некоторых приборах, даже бытовых, это тоже имеет значение.