Трудно представить современное строительство, технику, машиностроение и другие важнейшие отрасли без применения главных металлических сплавов из стали и чугуна. Их производство превышает все остальные в десятки раз.
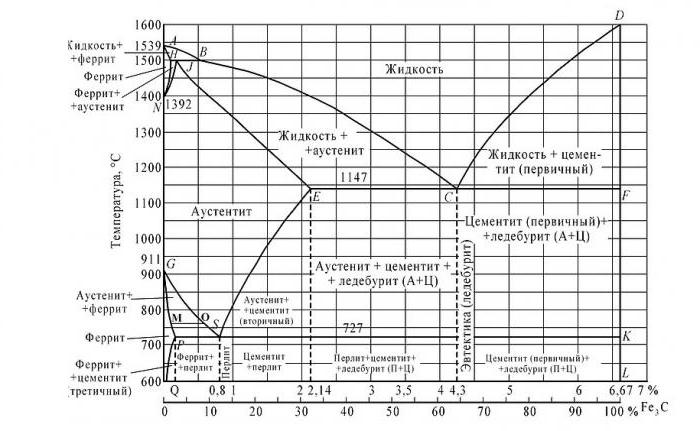
Если рассмотреть сталь и чугун с точки зрения такой науки, как металловедение, то центральной фигурой предстает диаграмма состояния сплавов железо-углерод, которая позволяет получить подробные представления о составе и структурных превращениях в этих материалах. А также познакомиться с их фазовым составом.
История открытия
Впервые на то, что в сплавах (сталях и чугунах) есть определенные (особые) точки, указал великий металлург и изобретатель - Дмитрий Константинович Чернов (1868 год). Именно он сделал важное открытие о полиморфных превращениях и является одним из создателей диаграммы состояния железо-углерод. По мнению Чернова, положение этих точек на диаграмме имеет прямую зависимость от процентного содержания углерода.
И что самое интересное, именно с момента этого открытия и начинает свою жизнь такая наука, как металлография.
Диаграмма сплавов железа с углеродом является результатом кропотливого труда ученных нескольких стран мира. Все буквенные обозначения главных точек и фаз в диаграмме являются интернациональными.
Понятие диаграммы
Графическое изображение процессов, происходящих в сплаве при изменении температурного режима, концентрации веществ, давления, называется диаграммой состояния. Она позволяет объемно и наглядно увидеть все превращения, происходящие в сплавах.
Элементы диаграммы железо-углерод
Краткая информация о каждом из этих элементов.
Железо – это серебристо-серый металл. Удельный вес - 7, 86 г/см3. Имеет температуру плавления 1539° С.
При взаимодействии железа и других металлов образуются соединения, называемые растворами замещения. Если с неметаллами, например с углеродом или водородом, то - растворами внедрения.
Железо имеет способность, будучи изначально твердым, находиться в нескольких состояниях, которые в металловедении принято называть "альфа" и "гамма". Это качество называется полиморфизмом. Об этом далее в статье.
Углерод – это неметалл. Если он выступает как графит, то температура плавления равна 3500° С. Если как алмаз - 5000° С. Плотность углерода - 2,5 г/см3. Он также обладает полиморфическими свойствами.
В сплавах железо-углерод этот элемент образует твердый раствор, в составе которого есть феррум, называемый цементитом (Fe3C). Также формирует графит в чугунах.
Диаграмма сплава железо-углерод
В результате взаимодействия составляющих диаграммы друг с другом, получается цементит – химическое соединение.
Как правило, при изучении диаграммы студентами-металловедами, все устойчивые соединения рассматриваются как компоненты, а само графическое изображение исследуется по частям.
Также на занятиях строят кривую охлаждения по диаграмме железо-углерод: выбирается процент углерода, а затем необходимо определить, какая фаза соответствует какой температуре на диаграмме.
Для этого необходимо кроме самой диаграммы начертить систему координат (температура-время). И начиная с максимальных градусов, двигаться постепенно вниз, изображая кривую и участки перехода одной фазы в другую. При этом необходимо называть их и указывать тип кристаллической решетки.
Далее рассмотрим подробнее само графическое изображение диаграммы состояния железо-углерод.
Во-первых, она имеет две формы (части):
- железо-цементит;
- железо-графит.
Во-вторых, сплавы, в которых главными "действующими лицами" является феррум и углерод, условно делят на:
- стали;
- чугуны.
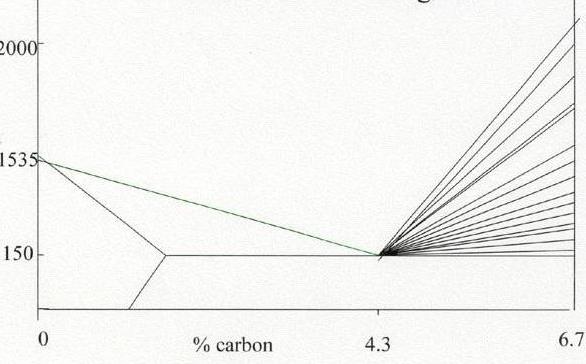
Если углерода в сплаве менее или равно 2,14 % (точка Е на диаграмме), то это сталь, если более 2,14 % – чугун. По этой причине и подразделяют диаграмму на две фазы.
Полиморфные превращения
Более подробно о каждой фазе чуть ниже в статье. А если кратко, то осуществление главных превращений происходит при особых температурах.
Состояние железа обозначают как α-феррум (при температуре менее 911° С) . Кристаллическая решетка – объемный гранецентрированный куб. Или ОЦК. Дистанция между атомами такой решетки достаточно высокая.
Железо приобретает модификацию гамма, то есть обозначается как γ-феррум (911-1392° С) . Кристаллическая решетка - гранецентрированный куб (ГЦК). В этой решетке дистанция между атомами ниже, чем в ОЦК.
При переходе α-феррума в γ-феррум объем вещества становится меньшим. Причиной тому является кристаллическая решетка – ее вид. Потому что решетка ГЦК имеет более упорядоченное состояние атомов, чем ОЦК.
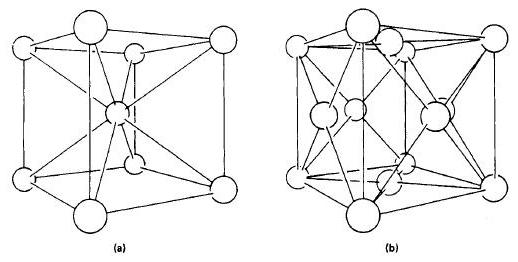
Если переход осуществляется в обратном направлении - из γ-феррума в α-феррум, то объем сплава увеличивается.
Когда температура достигает значения 1392° С (но менее температуры плавления железа 1539° С), то α-феррум превращается в δ-феррум, но это не является ее новой формой, а лишь разновидностью. К тому же δ-феррум является неустойчивой структурой.
Свойства технически чистого железа
Магнитные свойства железа при различных температурах:
- менее 768° С – ферромагнитно;
- более 768° С – парамагнитно.
А температурную точку 768° С называют точкой магнитного превращения, или точкой Кюри.
Свойства технически чистого железа:
- твердость – 80 НВ;
- временное сопротивление - 250 МПа;
- предел текучести – 120 МПа;
- относительное удлинение 50 %;
- относительное сужение – 80 %;
- высокий модуль упругости.

Карбид железа
Графический вид составляющей части диаграммы железо-углерод: Fe3C. Вещество называется карбидом железа, или цементитом. Для него характерно:
- Содержание углерода 6,67 %.
- Удельный вес - 7,82 %.
- Кристаллическая решетка имеет ромбическую форму, состоящую из октаэдров.
- Плавление происходит при температуре ≈1260° С.
- Низкие ферромагнитные свойства при пониженной температуре.
- Твердость – 800 НВ.
- Пластичность практически равна нулю.
- Карбид железа образует твердые растворы замещения, в которых атомы углерода замещаются атомами неметаллов (азотом), а атомы железа – металлами (хромом, вольфрамом, марганцем). Этот твердый состав называется легированным.
Как уже отмечалось выше, цементит – это нестабильная фаза, а графит – стабильная. Поскольку первое вещество представляет собой неустойчивое соединение, распадаясь при определенных температурных условиях.

В диаграмме железо-углерод есть такие состояния:
- жидкая фаза;
- феррит;
- аустенит;
- цементит;
- графит;
- перлит;
- ледебурит.
Рассмотрим каждую из них подробно.
Жидкая фаза
Феррум в жидком состоянии хорошо растворяет углерод. Это независимо от того, в какой пропорции они находятся по процентному содержанию. В результате образуется однородная жидкая масса.
Феррит
Является твердым раствором внедрения углерода в α-ферруме. Также может быть включено небольшое количество примесей. Но феррит имеет почти одинаковые качества, как и чистое железо. Если рассмотреть структуру под микроскопом, то можно увидеть полиэдрические зерна светлого тона.
Бывает:
- низкотемпературный (при температуре 727° С растворимость углерода 0,02 %);
- высокотемпературный (при 1499° С растворимость углерода 0,1 %), или его называют δ-феррум.
Свойства феррита:
- твердость - 80-120 НВ;
- временное сопротивление - 300 МПа;
- относительное удлинение - 50 %;
- обладает хорошими магнитными свойствами (до температуры 768° С).
Аустенит
Это твердый раствор внедрения углерода в γ-ферруме. Также могут быть в небольшом количестве примеси. В кристаллической решетке углерод находится в центре ГЦК ячейки. При рассмотрении структуры аустенита под микроскопом, виден как светлые зерна полиэдрической формы с двойниками.
Обладает следующими характеристиками:
- Растворимость углерода в γ-ферруме 2,14 % (при температуре 1147° С).
- Твердость аустенита 180 НВ;
- Удлинение - 40-50 %;
- Хорошие парамагнитные качества.
Цементит и его формы
Присутствует в таких фазах: Ц1, Ц2, Ц3 (первичный, вторичный и третичный цементит).
Что касается физико-химических показателей этих трех состояний, то они приблизительно равны. На механические свойства влияет размер частиц, их количество и расположение.
Также по диаграмме видно, что:
- Ц1 образуется из жидкого состояния (под микроскопом он виден как пластины крупной величины);
- Ц2 – из аустенита (располагаясь вокруг его зерен в виде сетки);
- Ц3 – из феррита (располагаясь у границ ферритных зерен в виде мелких частиц).
Перлит и ледебурит
Смесь феррита и цементита называется перлитом. Он образуется при распаде аустенита (при температуре менее 727° С). При увеличении эта структура имеет форму пластин или зерен.
Перлит при постепенном снижении температуры присутствует во всех сплавах с содержанием углерода 0,02-6,67 %.
Ледебурит - смесь аустенита и цементита. Он образуется из жидкой фазы при охлаждении до температуры ниже 1147° С.
Чугуны
Сплавы на диаграмме железо-углерод, которые содержат углерода более, чем 2,14 %, называются чугунами. Они обладают высокой хрупкостью. Поперечное сечение такого чугуна имеет светлый тон, а потому его называют белым чугуном.
На диаграмме это точка С, называемая эвтектикой, с соответствующим содержанием углерода 4,3 %. При кристаллизации образуется смесь, состоящая из аустенита и цементита, в совокупности называемая ледебуритом. Фазовый состав постоянен.
При концентрации углерода менее 4,3 % (доэвтектический чугун) при кристаллизации выделяется аустенит из раствора. Далее из него выделяется Ц2. А при 727° С аустенит превращается в перлит. Структурное состояние такого чугуна следующее: крупные участки перлита темного тона.
В заэвтектическом белом чугуне (углерода более 4,3%) при охлаждении структурирование происходит с образованием кристаллов Ц1. Далее превращения осуществляются уже в твердом состоянии. Структура представляет собой ледебурит, который является фоном для полей перлита темного тона. А крупные пласты – это Ц1.
Выводы
Достичь абсолютного равновесия, как физического, так и химического, невозможно, кроме как в специальных лабораторных условиях.
На практике равновесие может быть приближено к абсолютному, но при определенных условиях: достаточно медленного повышения или понижения температуры сплава, который будет длительно выдерживаться по времени.


























