Разнообразен и интересен мир металлов. Их свойства издавна изучались человеком, и нашу жизнь просто невозможно представить без таких элементов, как железо, алюминий, хром. В нашей статье речь пойдет о натрии.
Строение атома натрия, расположение электронов по энергетическим уровням определяют его главные характеристики. К ним, например, относятся такие показатели, как высокая химическая активность, пластичность, способность проводить тепло и электрический ток.
Но особое внимание стоит уделить рассмотрению строения элементарной частицы химического элемента натрия – его атома.
Самые активные и агрессивные
Щелочные металлы, к которым относится натрий, в химии по праву считаются самыми реакционно-способными. Именно поэтому ни один из них, в том числе и натрий, не встречается в природе как самородок, а находится в ионном виде в составе горных пород и минералов.
К ним относится поваренная соль, сильвинит и карналлит. Чем же можно это объяснить?
Ответ лежит в особенностях строения атома натрия. Элемент, как и его собратья по подгруппе щелочных металлов, имеет большой радиус атома. Кроме того, его единственный электрон, расположенный на последнем энергетическом уровне, слабо связан с положительно заряженным ядром. Поэтому он легко отрывается от самого атома и захватывается частицами других химических элементов. Эта способность – легко отдавать собственные электроны - и определяет все главные свойства металлических элементов.

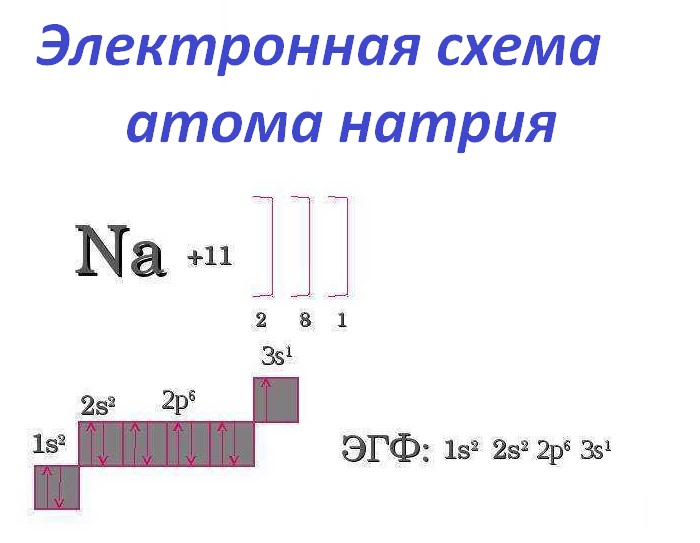
Электронное строение атома натрия
Полная формула, показывающая распределение электронов по энергетическим уровням в атоме, имеет следующий вид: 1s22s22p63s1.
Последний неспаренный электрон, при вращении образующий облако в виде сферы, находится на значительном удалении от собственного ядра. Он участвует в возникновении такого типа связи, как ионное взаимодействие, и называется валентным.
Радиус самого атома составляет около 0,189 нм, а энергия его ионизации равна 5,14 эВ. Благодаря такому строению атома элемента натрия, его простое вещество проявляет хорошо выраженные восстановительные свойства, то есть в реакциях с атомами других элементов всегда отдает свой единственный электрон, расположенный на последнем энергетическом уровне (третий).
При этом электронейтральная частица натрия превращается в положительно заряженный ион – катион. Ярко выраженные восстановительные свойства металла и его химическая активность предъявляют особые требования к условиям его хранения. Чтобы металл не окислялся кислородом воздуха, его сберегают под слоем технического масла или керосина. Электронная схема атома натрия имеет следующий вид (см. фото ниже).
Физические свойства
Какова же зависимость между электронной формулой и физическими свойствами натрия? Строение атома натрия раскрывает эту взаимосвязь.
Природный Na состоит только из одного изотопа. Он представляет собой очень мягкий серебристо-белый металл, который можно резать ножом. Его плотность составляет всего 0,97 г/см.
Как и другие металлы, натрий хорошо проводит электрический ток и тепло. Поскольку в подгруппе щелочных металлов радиусы атомов и их свойства как восстановителей с увеличением заряда ядра увеличиваются, то температуры кипения и плавления будут уменьшаться.
Как строение атома влияет на химические свойства элемента?
Продолжим изучение строения атома натрия. Натрий содержит на третьем энергетическом уровне один электрон, электронное облако которого имеет форму сферы. Поэтому металл относят к s-элементам, а они, как известно, легко вступают в химическое взаимодействие с неметаллами, например с кислородом, водородом, серой, азотом и т. д. Реагируя с водой, натрий быстро растворяется в ней, образуя раствор щелочи.

Высокая активность щелочного металла натрия выражается в особенностях его взаимодействия с кислотами, которая сопровождается взрывом. Поэтому такую реакцию в лабораторных условиях проводить запрещено. Еще одна особенность металлического натрия заключается в том, что он не реагирует с растворами солей и щелочей, так как сам начинает активно взаимодействовать с растворителем – водой.
Так что, как можно видеть, строение атома натрия, а также его взаимосвязь с физическими и химическими свойствами элемента, действительно представляют собой научный интерес.


























Строение электронной оболочки атомов на примере натрия.