Амины - это... Строение, свойства, классы аминов
Амины вошли в нашу жизнь совершенно неожиданно. Еще недавно это были ядовитые вещества, столкновение с которыми могло привести к смерти. И вот, спустя полтора столетия, мы активно пользуемся синтетическими волокнами, тканями, строительными материалами, красителями, в основе которых лежат амины. Нет, они не стали безопаснее, просто люди смогли их "приручить" и подчинить, извлекая для себя определенную пользу. О том, какую именно, и поговорим далее.
Определение
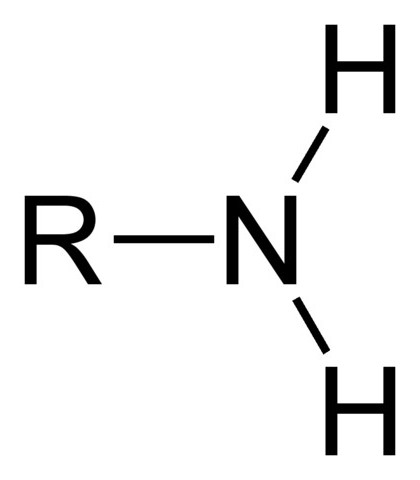
Амины – это органические соединения, являющиеся производными аммиака, в молекулах которого водород замещен углеводородными радикалами. Их может быть до четырех одновременно. Конфигурация молекул и количество радикалов определяют физические и химические свойства аминов. Кроме углеводородов, такие соединения могут содержать ароматические или алифатические радикалы, либо их комбинацию. Отличительным признаком данного класса является наличие R-N-фрагмента, в котором R – это органическая группа.
Классификация

Все амины можно разделить на три большие группы:
- По природе углеводородного радикала.
- По числу радикалов, связанных с атомом азота.
- По количеству аминогрупп (моно-, ди-, три - и т. д.).
В первую группу входят алифатические, или предельные амины, представителями которых являются метиламин и метилэтиламин. А также ароматические - например, анилин или фениламин. Названия представителей второй группы напрямую связаны с количеством углеводородных радикалов. Так, выделяют первичные амины (содержащие одну группу азота), вторичные (имеющие две группы азота в комбинации с различными органическими группами) и третичные (соответственно, имеющие три группы азота). Названия третичной группы говорят сами за себя.
Номенклатура (образование названия)
Для образования названия соединения к наименованию органической группы, которая связывается с азотом, добавляют приставку «амин», а сами группы упоминаются в алфавитном порядке, например: метилпротиламин или метилдифениламин (в данном случае «ди» указывает на то, что в соединении есть два радикала фенила). Допускается составлять название, основой которого будет углерод, а аминогруппу представлять в виде заместителя. Тогда положение ее определяется индексом под обозначением элемента, например, СН3СН2СН(NH2)CH2CH3. Иногда в верхнем правом углу цифрой указывается порядковый номер углерода.
Некоторые соединения до сих пор сохраняют тривиальные, общеизвестные упрощенные названия, такие как анилин, например. Кроме того, среди них могут встречаться такие, что имеют неправильно составленные названия, использующиеся наравне с систематическими, потому что ученым и людям, далеким от науки, так проще и удобнее общаться и понимать друг друга
Физические свойства
Вторичный амин, как и первичный, способен образовывать водородные связи между молекулами, хоть и чуть более слабые, чем обычно. Этот факт объясняет более высокую температуру кипения (выше ста градусов), присущую аминам, по сравнению с другими соединениями, имеющими аналогичную молекулярную массу. Третичный амин, из-за отсутствия N-H-группы, не способен образовывать водородные связи, поэтому начинает закипать уже при восьмидесяти девяти градусах по Цельсию.
При комнатной температуре (восемнадцать – двадцать градусов Цельсия) только низшие алифатические амины находятся в виде пара. Средние же пребывают в жидком состоянии, а высшие – в твердом. Все классы аминов имеют специфический запах. Чем меньше в молекуле органических радикалов, тем он отчетливей: от практически лишенных запаха высших соединений к пахнущим рыбой средним и воняющим аммиаком нижним.
Амины могут образовывать прочные водородные связи с водой, то есть являются хорошо растворимыми в ней. Чем больше в молекуле присутствует углеводородных радикалов, тем менее она растворима.
Химические свойства
Как логично предположить, амины – это производные аммиака, а значит, и свойства у них сходные. Условно можно выделить три вида химического взаимодействия, которые возможны у данных соединений.
- Сначала рассмотрим свойства аминов как оснований. Низшие (алифатические), соединяясь с молекулами воды, дают щелочную реакцию. Связь образуется по донорно-акцепторному механизму, за счет того, то атом азота имеет непарный электрон. При взаимодействии с кислотами все амины образуют соли. Это твердые, хорошо растворимые в воде вещества. Ароматические амины проявляют более слабые свойства оснований, так как их неподеленная электронная пара смещается к бензольному кольцу и взаимодействует с его электронами.
- Окисление. Третичный амин легко окисляется, соединяясь с кислородом в атмосферном воздухе. Кроме того, все амины способны воспламеняться от открытого пламени (в отличие от аммиака).
- Взаимодействие с азотистой кислотой используется в химии для того, чтобы различать амины между собой, так как продукты данной реакции зависят от количества органических групп, присутствующих в молекуле:
- низшие первичные амины образуют в результате реакции спирты;
- ароматические первичные в аналогичных условиях дают фенолы;
- вторичные превращаются в нитрозосоединения (о чем свидетельствует характерный запах);
- третичные образуют соли, которые быстро разрушаются, поэтому ценности такая реакция не представляет.
Особые свойства анилина
Анилин представляет собой соединение, имеющее свойства, присущие как аминогруппе, так и группе бензолов. Объясняется это взаимным влиянием атомов внутри молекулы. С одной стороны, бензольное кольцо ослабляет основные (т. е. щелочные) проявления в молекуле анилина. Они ниже, чем у алифатических аминов и аммиака. Но с другой, когда аминогруппа оказывает влияние на бензольное кольцо, оно становится, наоборот, более активным и вступает в реакции замещения.
Для качественного и количественного определение анилина в растворах или соединениях используется реакция с бромной водой, в конце которой на дно пробирки выпадает белый осадок в виде 2,4,6-триброманилина.
Амины в природе
Амины встречаются в природе повсеместно в виде витаминов, гормонов, промежуточных продуктов обмена, есть они и в организме животных и в растениях. Кроме того, при гниении живых организмов также получаются средние амины, которые в жидком состоянии распространяют неприятный запах селедочного рассола. Широко описанный в литературе «трупный яд» появился именно благодаря специфическому амбре аминов.
Длительное время рассматриваемые нами вещества путали с аммиаком из-за похожего запаха. Но в середине девятнадцатого века французский химик Вюрц смог синтезировать метиламин и этиламин и доказать, что при сгорании они выделяют углеводород. Это было принципиальным отличием упомянутых соединений от аммиака.
Получение аминов в промышленных условиях
Так как атом азота в аминах находится в низшей степени окисления, то восстановление азотосодержащих соединений является наиболее простым и доступным способом их получения. Именно он широко распространен в промышленной практике из-за своей дешевизны.
Первый метод представляет собой восстановление нитросоединений. Реакция, во время которой образуется анилин, носит название ученого Зинина и была проведена в первый раз в середине девятнадцатого века. Второй способ заключается в восстановлении амидов при помощи алюмогидрида лития. Из нитрилов тоже можно восстановить первичные амины. Третий вариант – реакции алкилирования, то есть введение алкильных групп в молекулы аммиака.
Применение аминов
Сами по себе, в виде чистых веществ, амины используются мало. Один из редких примеров – полиэтиленполиамин (ПЭПА), который в бытовых условиях облегчает затвердение эпоксидной смолы. В основном первичный, третичный или вторичный амин – это промежуточный продукт в производстве различных органических веществ. Самым востребованным является анилин. Он – основа большой палитры анилиновых красителей. Цвет, который получится в конце, зависит непосредственно от выбранного сырья. Чистый анилин дает синий цвет, а смесь анилина, орто- и пара-толуидина будет красной.
Алифатические амины нужны для получения полиамидов, таких как нейлон и другие синтетические волокна. Они применяются в машиностроении, а также в производстве канатов, тканей и пленок. Кроме того, алифатические диизоцинаты используются в изготовлении полиуретанов. Из-за своих исключительных свойств (легкость, прочность, эластичность и способность прикрепляться к любым поверхностям) они востребованы в строительстве (монтажная пена, клей) и в обувной промышленности (противоскользящая подошва).
Медицина - еще одна сфера, где применяются амины. Химия помогает синтезировать из них антибиотики группы сульфаниламидов, которые успешно применяют в качестве препаратов второй линии, то есть резервной. На случай, если у бактерий разовьется устойчивость к основным лекарствам.
Вредное воздействие на организм человека
Известно, что амины – это весьма токсичные вещества. Вред здоровью может нанести любое взаимодействие с ними: вдыхание паров, контакт с открытой кожей или попадание соединений внутрь организма. Смерть наступает от нехватки кислорода, так как амины (в частности, анилин) связываются с гемоглобином крови и не дают ему захватывать молекулы кислорода. Тревожными симптомами являются одышка, посинение носогубного треугольника и кончиков пальцев, тахипноэ (учащенное дыхание), тахикардия, потеря сознания.
В случае попадания этих веществ на оголенные участки тела необходимо быстро убрать их ватой, предварительно смоченной в спирте. Делать это надо максимально аккуратно, чтобы не увеличить площадь загрязнения. Если появятся симптомы отравления – обязательно нужно обратиться к врачу.
Алифатические амины – это яд для нервной и сердечно-сосудистой систем. Они могут вызвать угнетение функций печени, ее дистрофию и даже онкологические заболевания мочевого пузыря.