Дикарбоновые кислоты: описание, химические свойства, получение и применение
Дикарбоновые кислоты – это вещества с двумя функциональными одновалентными карбоксильными группами – СООН, функция которых заключается в определении основных свойств этих веществ.
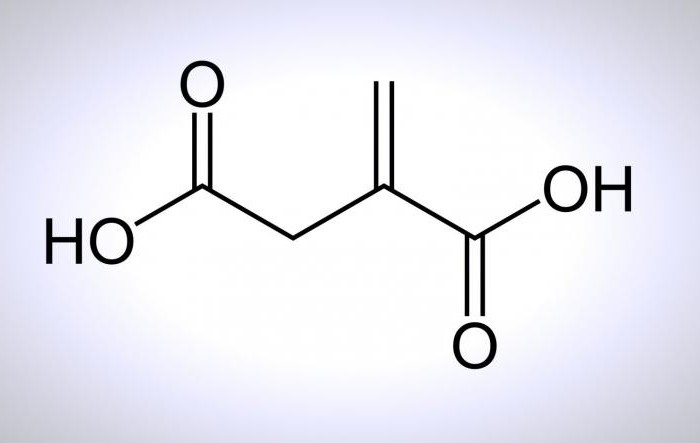
Их общая формула – HOOC-R-COOH. И здесь под «R» подразумевается любой органический 2-валентный радикал, представляющий собой атомы, соединенные с функциональной группой молекулы. Впрочем, об этом можно поподробней.
Физические свойства
Дикарбоновые соединения представляют собой твердые вещества. Можно выделить следующие физические свойства:
- Отлично растворяются в воде. При этом образуют водородные межмолекулярные связи.
- Граница растворимости в Н2О находится в пределе С6-С7. И это понятно, ведь содержание карбоксильной полярной группы в молекулах значительно.
- Плохо растворяются в растворителях органического происхождения.
- Плавятся при намного более высоких температурах, чем спирты и хлориды. Это из-за высокой прочности их водородных связей.
- Если карбоксильные соединения подвергнуть нагреванию, то они начнут разлагаться с выделением различных веществ.
Химические свойства
Они у карбоновых кислот точно такие же, как и у монокарбоновых. Почему? Потому что в них также имеется карбоксильная группа. Она, в свою очередь, состоит из двух элементов:
- Карбонил. >C=O. Группа =С=О органических соединений (тех, в состав которых входит углерод).
- Гидроксил. –ОН. Группа ОН соединений органического и неорганического типов. Связь между атомами кислорода и водорода ковалентная.
Карбонил и гидроксил оказывают взаимное влияние. Чем именно обусловлены кислотные свойства рассматриваемых соединений? Тем, что поляризация связи О-Н вызывает смещение к карбонильному кислороду электронной плотности.
Стоит отметить, что в водных растворах вещества карбоксильной группы диссоциируют (распадаются) на ионы. Это выглядит так: R-COOH = R-COO- + H+. Кстати, высокие температуры кипения кислот и их способность растворяться в воде обуславливаются образованием водородных межмолекулярных связей.
Диссоциация
Это одно из свойств дикарбоновых кислот, проявляющееся в распаде вещества на ионы при растворении. Происходит в две стадии:
- НООС-Х-СООН → НООС-Х-СОО-+Н+. По первой стадии дикарбоновые кислоты являются сильнее монокарбоновых. Причина № 1 – статистический фактор. В молекуле присутствует 2 карбоксильные группы. Причина № 2 – взаимное их влияние. Которое происходит в большинстве случаев, так как группы либо связаны цепью кратных связей, либо находятся недалеко.
- НООС-Х-СОО- → -ООС-Х-СОО-+Н+. А вот на второй стадии кислоты данной группы становятся слабее монокарбоновых. За исключением разве что этандиовой (щавелевой). Катион водорода отделяется сложнее. Для этого требуется больше энергии. Н+ труднее отделить от аниона с -2 зарядом, чем от -1.
Диссоциация дикарбоновых кислот происходит только в водных растворах, хотя также в иных случаях данный химический процесс возможен при плавлении.
Другие реакции
Рассматриваемые соединения могут образовывать соли. И не обычные, как монокарбоновые, а кислые. Их характеризует наличие в составе двух видов катионов – металла (в некоторых реакциях вместо них ионы аммония) и водорода. Также у них имеется многозарядный анион кислотного остатка – отрицательно заряженный атом.
Название этих солей обусловлено тем, что при гидролизе они дают кислую реакцию среды. Стоит отметить, что данные соединения диссоциируют на остаток с частицей водорода и ионы металла.
Также химические свойства дикарбоновых кислот обуславливают их возможность образовывать галогенангидриды. В этих соединениях гидроксильная группа замещается галогеном – энергичным окислителем.
Особенности
Нельзя не оговориться, что к свойствам дикарбоновых кислот также относится образование хелатов. Это – комплексные соединения, состоящие из циклических группировок с комплексообразователем (центральным ионом).
Хелаты используются для разделения, аналитического определения и концентрирования самых разных элементов. А в сельском хозяйстве и медицине их используют для ввода в пищу таких микроэлементов, как марганец, железо, медь и т. д.
Еще некоторые дикарбоновые кислоты образуют циклические ангидриды – соединения R1CO-O-COR2, которые являются ацилирующими агентами, имеющими способность вступать в реакции с нуклеофилами, электроноизбыточными химическими реагентами.
И последняя особенность дикарбоновых кислот – это образование ими полимеров (высокомолекулярных веществ). Оно происходит вследствие реакции с иными полифункциональными соединениями.
Способы получения
Их много, и каждый из них направлен на синтез дикарбоновой кислоты определенного типа. Но есть несколько общих способов:
- Окисление кетонов – органических соединения с карбонильной группой =СО.
- Гидролиз нитрилов. То есть, разложение органических соединений с формулой R—C≡N посредством воды. Нитрилы, как правило, являются твердыми или жидкими веществами с отличной растворимостью.
- Карбонилирование диолов – веществ с двумя гидроксильными группами. Реакция подразумевает введение карбонильных групп С=О посредством реакции с оксидом углерода – очень токсичным газом, который легче воздуха, и не имеет ни запаха, ни вкуса.
- Окисление диолов.
Любой из этих способов приведет к получению дикарбоновых кислот. Которых в природе очень много. Названия большинства из них на слуху у каждого, поэтому о них тоже стоит вкратце рассказать.
Виды кислот
Первым делом стоит отметить, что у них у всех по два названия:
- Систематическое. Дается по названию алкана (ациклического углеводорода) с добавлением суффикса «-диовая».
- Тривиальное. Дается по названию природного продукта, из которого получается кислота.
А теперь непосредственно о соединениях. Итак, вот некоторые наиболее известные кислоты:
- Щавелевая/этандиовая. НООС-СООН. Содержится в карамболе, ревене, щавеле. Также существует в виде оксалатов (солей и эфиров) кальция и калия.
- Малоновая/пропандиовая. НООС-СН2-СООН. Содержится в соке сахарной свеклы.
- Янтарная/бутандиовая. НООС-(СН2)2-СООН. Выглядит, как бесцветные кристаллы, отлично растворяющиеся в спирте и воде. Содержится в янтаре и в большинстве растений. Соли и эфиры дикарбоновой кислоты данного типа называют сукцинатами.
- Глутаровая/Пентандиовая. HOOC—(CH2)3—COOH. Получают посредством окисления азотной кислотой циклического кетона и участием оксида ваниадия.
- Адипиновая/Гександиовая. НООС(СН2)4СООН. Получают посредством окисления циклогексана в две стадии.
Кроме перечисленного, еще есть гептандиовая кислота, нонандиовая, декандиовая, ундекандиовая, додекандиовая, тридекандиовая, гексадекандиовая, генэйкозандиовая и многие другие.
Ароматические дикарбоновые кислоты
О них тоже стоит сказать пару слов. Фталевые кислоты – важнейший представитель данной группы. Они не являются значимым в промышленном плане продуктом, но представляют собой интерес. Поскольку образуются вследствие получения фталевого ангидрида – вещества, с помощью которого синтезируют красители, смолы и некоторые составляющие лекарственных средств.
Еще есть терафлевая кислота. Она, взаимодействуя со спиртами, дает сложные эфиры – производные оксокислот. Ее активно применяют в промышленности. С помощью терафлевой кислоты получают насыщенные полиэфиры. А их задействуют в производстве пищевых контейнеров, пленки для видео-, фото-, аудиозаписей, бутылок для напитков и т. д.
Следует отметить вниманием и изофталевую ароматическую кислоту. Ее применяют в качестве сомономера – низкомолекулярного вещества, образующего полимер вследствие реакции полимеризации. Данное ее свойство используется в производстве резины и пластика. А еще из нее изготавливают изолирующие материалы.
Применение
Об этом напоследок. Если говорить о применении двухосновных карбоновых кислот, тои стоит заметить, что:
- Они являются исходным сырьем, с помощью которого получают галогенангидриды, кетоны, виниловые эфиры и прочие важные органические соединения.
- Определенные кислоты задействованы в производстве сложных эфиров, применяемых в дальнейшем в парфюмерии, текстильной промышленности, кожевенном деле.
- Некоторые из них содержатся в консервантах и растворителях.
- Без них не обходится производство капрона – синтетического полиамидного волокна.
- В изготовлении термопластика под названием полиэтилентерефталат также используют некоторые кислоты.
Впрочем, это лишь некоторые сферы. Есть еще масса других областей, в которых применяют конкретные виды двухосновных кислот. Щавелевая, например, используется, как протрава в промышленности. Или как осадитель металлических покрытий. Субериновая задействована в синтезе лекарственных средств. Из азелаиновой делают полиэфиры, применяемые в производстве маслостойких электрошнуров, шлангов и трубопроводов. Так что, если подумать, очень мало тех областей, где двухосновные кислоты не нашли бы своего применения.