Константа кислотности: определение, формула рассчета, использование
Константа кислотности - важнейший показатель силы кислоты. Понимание ее сущности помогает химикам прогнозировать поведение веществ в реакциях. Давайте разберемся, что из себя представляет эта константа и как она влияет на протекание химических процессов.
Определение константы кислотности
Константа кислотности (Ka) - это величина, количественно характеризующая силу кислоты. Она показывает, в какой степени молекула кислоты отдает протон молекуле воды по уравнению:
AH + H2O → A- + H3O+
Чем выше значение Ka, тем сильнее кислота, и тем полнее она диссоциирует с образованием ионов в водном растворе.
Математически константу кислотности можно рассчитать по формуле:
Ka = [H3O+][A-]/[HA]
где:
- [H3O+] - равновесная концентрация гидроксониевых ионов;
- [A-] - равновесная концентрация анионов кислотного остатка;
- [HA] - равновесная концентрация недиссоциированных молекул кислоты.
На численное значение Ka влияют такие факторы, как природа кислоты, температура раствора и используемый растворитель.
Классификация кислот по силе с помощью pKa
Для удобства сравнения кислот по силе используют величину pKa, которая равна отрицательному десятичному логарифму константы кислотности:
pKa = -lgKa
Чем меньше значение pKa, тем сильнее кислота. По значению pKa все кислоты делят на:
- Сильные (pKa < 0)
- Средние (0 < pKa < 7)
- Слабые (pKa > 7)
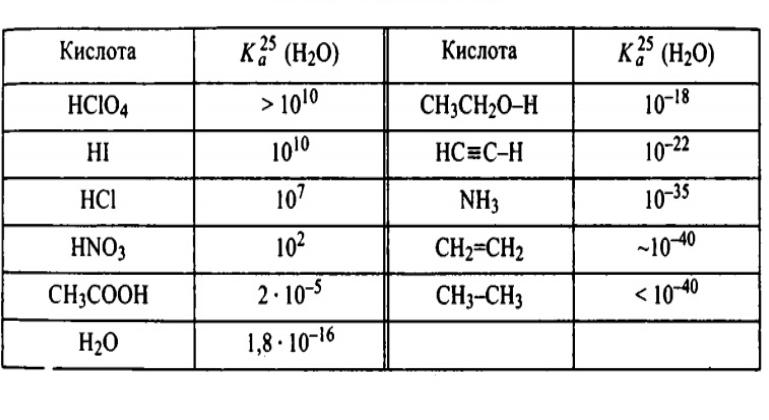
Например, соляная кислота считается сильной (pKa = -6,3), а уксусная - слабой (pKa = 4,8).
| Кислота | pKa |
| Соляная (HCl) | -6,3 |
| Уксусная (CH3COOH) | 4,8 |
Влияние константы кислотности на химические реакции
Константа кислотности определяет такие важные свойства кислоты, как:
- Степень диссоциации в водных растворах;
- Скорость реакций с ее участием;
- Положение равновесия в реакциях кислотно-основного взаимодействия.
Рассмотрим подробнее каждый из этих аспектов.
Степень диссоциации кислоты показывает, какая доля ее молекул распадается на ионы в растворе. Этот параметр напрямую зависит от константы Ka: чем она выше, тем выше степень диссоциации. Например, для такой сильной кислоты как соляная в воде степень диссоциации близка к 100%, то есть практически все молекулы HCl распадаются на H+ и Cl-. Для слабой уксусной кислоты этот показатель гораздо ниже.
Скорость реакций с участием кислот также зависит от константы Ka. Как правило, реакции с сильными кислотами идут гораздо быстрее из-за высокой концентрации образующихся ионов H+. Эти ионы являются катализаторами многих процессов.
Равновесие реакций кислотно-основного взаимодействия смещается в ту сторону, где образуется более сильный электролит. Поэтому зная константы кислотности исходных веществ, можно точно предсказать направление реакции и рассчитать выход продуктов. Эти знания широко используются на практике для оптимизации химических процессов.
Экспериментальные методы определения констант кислотности
Существует несколько лабораторных методов, позволяющих экспериментально определить значение константы кислотности для конкретного вещества. Рассмотрим основные из них.
Потенциометрическое титрование
Это один из наиболее точных методов. Суть его заключается в следующем: исследуемый раствор кислоты постепенно титруют раствором сильного основания. При этом фиксируют изменение pH в зависимости от объема добавленного титранта. По полученным данным строят кривую титрования и рассчитывают константу кислотности.
Спектрофотометрический метод
Он основан на зависимости оптической плотности раствора от концентрации частиц в нем. Раствор исследуемой кислоты помещают в кювету спектрофотометра и регистрируют спектр поглощения. Затем постепенно изменяют pH, добавляя щелочь, и снимают спектры при разных значениях pH. Константу кислотности находят, анализируя зависимость оптической плотности от pH.
ЯМР-спектроскопия
Этот метод основан на анализе спектров ЯМР исследуемого вещества в зависимости от кислотности среды. По смещениям сигналов от протонов кислоты можно рассчитать ее константу диссоциации Ka. ЯМР-спектроскопия позволяет определить константы кислотности даже очень слабых кислот, для которых другие методы не подходят.
Взаимосвязь строения и кислотности органических соединений
Существует четкая корреляция между строением молекулы органического вещества и величиной его константы кислотности. Это позволяет делать обоснованный прогноз кислотных свойств соединения, зная его структурную формулу.
Влияние заместителей на кислотные свойства
Например, для карбоновых кислот введение в молекулу электроноакцепторных заместителей (NO2, CN и др.) увеличивает константу кислотности. А наличие электронодонорных групп (NH2, OH), наоборот, ее уменьшает. Таким образом, регулируя состав заместителей, можно влиять на силу кислоты и оптимизировать ее для конкретных целей.
Кислотность различных классов органических соединений
Помимо отдельных заместителей, на кислотные свойства влияет также общая структура молекул. Например, производные карбоновых кислот, как правило, гораздо сильнее неорганических аналогов. А в ряду однотипных органических кислот кислотность увеличивается с ростом молекулярной массы.
Зная такие закономерности, можно делать качественный и количественный прогноз констант кислотности для широкого круга соединений без экспериментального определения. Это значительно упрощает поиск новых перспективных кислот с заданными свойствами.
Практическое применение данных о константах кислотности
Информация о константе кислотности широко используется на практике для решения следующих задач:
- Расчет и регулирование pH реакционных сред;
- Подбор оптимальных условий проведения химических процессов с участием кислот;
- Определение равновесных концентраций веществ в растворах.
Например, исходя из константы Ka, можно рассчитать pH раствора кислоты заданной концентрации. Это позволяет точно установить нужную реакционную среду добавлением щелочи или буферных смесей. Также по значению pKa определяют оптимальную температуру процесса, исходя из температурной зависимости степени диссоциации кислоты.
Константа основности и ее связь с константой кислотности
Помимо кислот, важную роль в реакциях играют основания. Их силу также можно охарактеризовать с помощью константы основности (Kb). Она показывает способность молекулы основания принимать протон от воды:
B + H2O → BH+ + OH-
Существует взаимосвязь между Kb основания и Ka его сопряженной кислоты. Чем сильнее кислота, тем слабее соответствующее основание, и наоборот. Это позволяет рассчитать константу основности, зная Ka кислоты и наоборот.