Модель Резерфорда: история, создание, принцип, влияние на науку
Научный прорыв Эрнеста Резерфорда в 1911 году навсегда изменил представления человечества о строении материи. Его революционная модель атома перевернула физику и химию.
Предпосылки создания планетарной модели атома Резерфорда
На протяжении XIX века физика накапливала экспериментальные факты о свойствах вещества, необходимые для построения полной картины строения атома. Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, создавший в 1869 году периодическую систему химических элементов.
Важным свидетельством сложного строения атомов стало открытие линейчатых оптических спектров, излучаемых различными химическими элементами. Уже в начале XIX века в спектре атомарного водорода были обнаружены отдельные спектральные линии в видимой области.
К концу XIX века появились теоретические гипотезы об электронном строении атомов. В 1896 году Хендрик Лоренц выдвинул предположение, что электроны являются составной частью атомов. Эту гипотезу в 1897 году подтвердил Джозеф Джон Томсон, открывший электрон и показавший, что он представляет собой элементарную частицу с наименьшим отрицательным зарядом.
Согласно модели строения атома, предложенной Томсоном в 1904 году, положительный заряд равномерно распределен по всему объему атома, а электроны движутся по круговым орбитам внутри этого положительно заряженного шара. Эта модель получила название "пудинг с изюмом".
Однако дальнейшие эксперименты опровергли равномерное распределение положительного заряда в атоме. В 1903 году Филипп Ленард, пропуская через тонкие металлические фольги пучки быстрых электронов, предположил, что атом состоит из нейтральных частиц или дуплетов с совмещенными положительными и отрицательными зарядами.
В 1904 году японский физик Хентаро Нагаока высказал гипотезу о том, что атом имеет планетарное строение с массивным положительно заряженным ядром, вокруг которого движутся электроны. Однако для проверки всех этих гипотез требовались решающие эксперименты.
Эксперименты Э. Резерфорда по рассеиванию альфа-частиц
В 1906 году Эрнест Резерфорд предложил оригинальный метод исследования внутренней структуры атома с помощью зондирования быстрыми α-частицами, испускаемыми при распаде радия и других радиоактивных элементов. Масса α-частиц примерно в 8000 раз больше массы электрона.
Если бы заряд в атоме был распределен равномерно, как предполагал Томсон, α-частицы прошли бы сквозь атом практически без отклонения. Но в опытах 1909 года под руководством Резерфорда было обнаружено, что значительная часть α-частиц рассеивается на большие углы и даже отражается назад после прохождения через тонкую золотую фольгу.
Это означало, что внутри атома имеется плотный положительно заряженный центр, в котором сосредоточена подавляющая часть массы. Расчеты Резерфорда показали, что размер этого ядра атома составляет примерно 10-12—10-13 см, то есть в десятки тысяч раз меньше размеров самого атома.
Сам Резерфорд признавался, что крайне удивился таким результатам и не ожидал отклонения частиц под большими углами, сравнивая это с эффектом от выстрела пушечным ядром в лист бумаги. Тем не менее, эксперименты однозначно свидетельствовали о существовании плотного положительно заряженного ядра в центре атома.
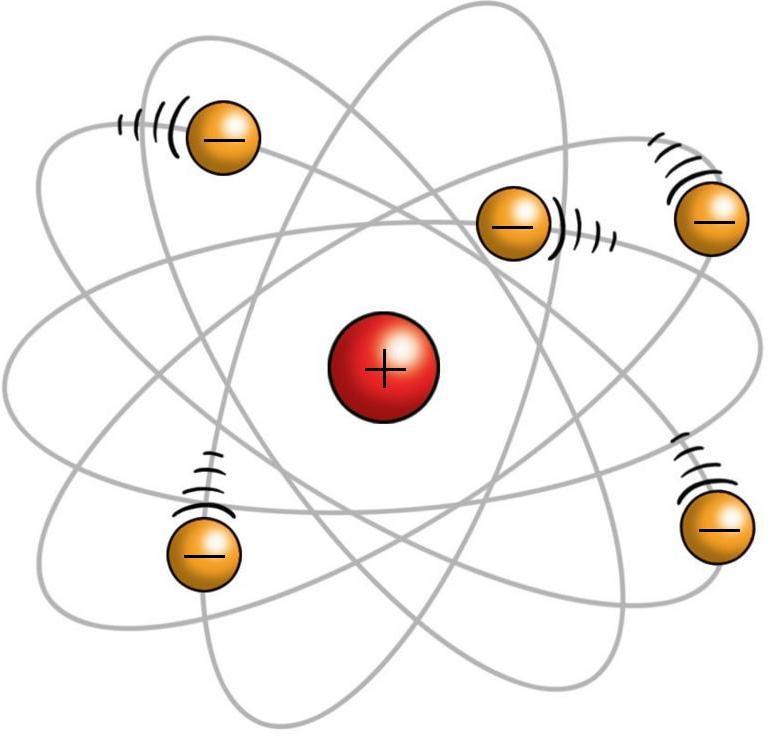
Планетарная модель атома Резерфорда
На основе результатов опытов по рассеянию α-частиц Резерфорд в 1911 году предложил планетарную модель строения атома, в которой:
- в центре атома находится положительно заряженное dense ядро, несущее почти всю его массу;
- вокруг ядра по орбитам движутся отрицательно заряженные электроны, как планеты вокруг Солнца;
- число электронов в атоме равно заряду ядра и определяет порядковый номер элемента в таблице Менделеева.
Ядро атома водорода, состоящего из одного протона, получило название протон. Его заряд равен элементарному положительному заряду +1, а масса в 1836 раз больше массы электрона.
Движение электронов по орбитам вокруг ядра под действием кулоновских сил обеспечивает устойчивость атома как целостной системы. Однако классическая теория не могла объяснить отсутствие излучения электронов при их ускоренном движении по орбитам. Это противоречие в дальнейшем привело к созданию квантовой механики.
Таким образом, планетарная модель Резерфорда, несмотря на свою наглядность, требовала дальнейшего развития для согласования с результатами опытов. Тем не менее, представление о компактном атомном ядре в центре атома оказалось верным и сохранилось в современной физике.
Экспериментальные подтверждения модели Резерфорда
Вскоре после выдвижения Резерфордом планетарной модели атома последовали важные экспериментальные работы, которые подтвердили ее основные положения.
В 1913 году Генри Мозли установил, что заряд атомного ядра действительно численно равен порядковому номеру элемента в таблице Менделеева. Этот вывод был сделан на основе детального анализа рентгеновских спектров.
Открытие изотопов - разновидностей химических элементов с разными массами ядер при одинаковом заряде - также подтвердило концентрацию основной массы атома в его ядре.
Наблюдение траекторий альфа-частиц в магнитных полях, регистрация спектральных линий атомов и другие опыты дали дальнейшие свидетельства существования планетарной модели атома Резерфорда. Хотя многие особенности требовали теоретического осмысления, само понятие компактного атомного ядра было прочно установлено.
Дальнейшее развитие теории строения атома
Хотя модель Резерфорда имела экспериментальное подтверждение, она не могла объяснить устойчивость атома и дискретность спектральных линий. Эти противоречия преодолела квантовая теория.
В 1913 году Нильс Бор выдвинул постулаты о квантовании орбит электронов и их переходах между стационарными орбитами с испусканием или поглощением фотонов. Это позволило объяснить линейчатые спектры и устойчивость атома.
Согласно принципу соответствия Бора, классическая механика Резерфорда выводится из квантовой в пределе больших квантовых чисел. Так произошел переход от классики к квантовой физике.
Значение работ Резерфорда для ядерной физики
Открытие ядра Резерфордом дало толчок для развития ядерной физики в первой половине XX века.
В 1919 году сам Резерфорд осуществил первую искусственную ядерную реакцию, расщепив ядра азота под действием альфа-частиц. В последующие годы им были открыты протон-протонные реакции в ядре и созданы первые ускорители заряженных частиц.
Открытие нейтрона в 1932 году позволило создать протон-нейтронные модели атомного ядра. Так заложенные Резерфордом идеи получили дальнейшее развитие в ядерной физике XX века.
Влияние на развитие химии и других наук
Планетарная модель атома Резерфорда оказала огромное воздействие на развитие не только физики, но и химии, астрофизики, космологии.
В химии стала понятна природа периодической системы Д.И. Менделеева связью с зарядом ядра. Были объяснены механизмы образования химической связи на основе электронных оболочек атомов.
В астрофизике модель атомного ядра позволила интерпретировать процессы в недрах звезд. В космологии объяснила механизмы ядерного синтеза в ранней Вселенной.
Память о Резерфорде
За выдающийся вклад в науку Эрнест Резерфорд был удостоен множества наград и званий. Его именем назван химический элемент рентгений.
В честь Резерфорда установлены памятники в Новой Зеландии, Великобритании и других странах. Его портреты размещены на денежных купюрах Новой Зеландии.
Имя этого выдающегося ученого носят научные центры и лаборатории по всему миру. Его революционная модель атома навсегда вошла в историю науки.
Личность Резерфорда
Эрнест Резерфорд родился в 1871 году в Новой Зеландии. Еще в юности он проявил незаурядные способности к точным наукам.
После учебы в Новой Зеландии Резерфорд переехал в Англию, где работал в Кембридже под руководством Дж. Дж. Томсона. В начале XX века он возглавил лабораторию в Манчестере, где и выполнил свои революционные работы по атомной физике.
В 1919 году Резерфорд вернулся в Кембридж, став профессором и директором лаборатории Кавендиша. Здесь он продолжил плодотворные исследования в области атомного ядра вплоть до своей кончины в 1937 году.
Научные школы Резерфорда
Эрнест Резерфорд оставил после себя целую плеяду выдающихся учеников и последователей, которые продолжили его дело.
В лаборатории Резерфорда в Манчестере работали такие видные физики, как Ганс Гейгер, Джеймс Чедвик, Эрнест Марсден. Они внесли большой вклад в изучение радиоактивности и строения атома.
В Кембридже у Резерфорда учились Пьер Кюри, Фрэнсис Астон, Джон Кокрофт, Эрнест Уолтон. Их работы заложили фундамент ядерной физики.
Таким образом, Резерфорд создал две крупные научные школы, оказавшие огромное влияние на развитие физики XX века.
Актуальность идей Резерфорда
Несмотря на прошествие более ста лет, представления Резерфорда об атомном ядре не потеряли актуальности и по сей день.
Модель атома Резерфорда лежит в основе современной ядерной энергетики, радиационной медицины, технологии изотопов. Она незаменима при интерпретации данных на ускорителях и коллайдерах элементарных частиц.
Ученые продолжают поиски "островов стабильности" сверхтяжелых элементов, расширяя периодическую систему Д.И. Менделеева, основанную на заряде атомного ядра.
Таким образом, революционная идея Резерфорда об атомном ядре сохраняет свое фундаментальное значение для науки и технологий и поныне.
Опыты Резерфорда сегодня
Эксперименты Резерфорда по рассеянию альфа-частиц до сих пор служат образцом для исследований строения атомного ядра.
Современные физики продолжают проводить такие опыты с использованием новейших ускорителей частиц и детекторов. Это позволяет получать ценную информацию о распределении заряда и плотности вещества внутри ядра.
Кроме того, ведутся работы по созданию мишеней из экзотических изотопов и даже антивещества для исследования процессов рассеяния.
Нобелевская премия Резерфорду
За пионерские работы по изучению распада радиоактивных элементов в 1908 году Эрнест Резерфорд был удостоен Нобелевской премии по химии.
Это стало признанием его выдающегося вклада в исследование внутреннего строения атома, который впоследствии принес ему мировую известность.
Хотя открытие атомного ядра Резерфордом произошло позже, Нобелевская премия 1908 года заложила фундамент его последующих достижений в физике.
Популяризация науки
Наряду с научной деятельностью, Резерфорд много внимания уделял популяризации физики и просвещению общества.
Он читал публичные лекции, писал научно-популярные книги и статьи в СМИ, давал интервью о новейших открытиях в области атомной физики.
Резерфорд считал важным донести достижения науки до широких слоев общества и пробудить интерес к фундаментальным исследованиям природы.
Наследие Резерфорда
Эрнест Резерфорд оставил поистине колоссальное научное наследие, изменившее ход развития физики и химии в XX веке.
Его открытие атомного ядра и планетарной модели атома перевернуло представления о строении материи. Оно лежит в основе современной науки.
Революционные идеи Резерфорда продолжают служить фундаментом для новых открытий по сей день. О его колоссальном вкладе в науку не забывают и через столетие после великих экспериментов.