Сера (лат. Sulfur ) — элемент-неметалл. Химический символ S, порядковый номер в таблице Менделеева — 16. Валентность серы была установлена еще до изучения строения атома. Определили ее значение на основании свойства замещать, притягивать либо присоединять некоторое количество других атомов или групп. Позже исследователи выяснили роль отрицательно заряженных частиц (электронов) в возникновении химической связи.
Валентность серы: какие особенности атомов влияют на ее значение?
По распространенности на Земле химический элемент находится на 16-м месте. Встречается в виде ярко-желтых кристаллов или порошка в горных породах, вблизи действующих и потухших вулканов. Наиболее известные природные соединения — сульфиды и сульфаты.
Особенности элемента и вещества:
- Сильный неметалл.
- По электроотрицательности (ЭО) или способности притягивать к себе электроны сера уступает только фтору, кислороду, азоту, хлору и брому.
- Взаимодействует с металлами и неметаллами, простыми и сложными веществами.
Отличия в свойствах зависят от строения и состояния атома, разницы в значениях ЭО. Выясним, какая валентность может быть у серы в соединениях. Их химическое поведение зависит от строения энергетических оболочек, числа и расположения внешних электронов в атоме.
Почему валентность бывает разной?
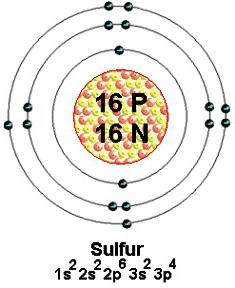
Стабильными являются естественные изотопы серы с массовыми числами 32 (наиболее распространенный), 33, 34 и 36. Атом каждого из этих нуклидов содержит 16 положительно заряженных протонов. В пространстве вблизи ядра передвигаются с огромной скоростью 16 электронов. Они бесконечно малы, отрицательно заряжены. Меньше притягиваются к ядру (более свободны) 6 внешних частиц. Несколько из них или все принимают участие в образовании разных типов химической связи. По современным представлениям валентность серы определяется числом созданных общих (связывающих) электронных пар. Обычно на рисунках и схемах внешние частицы, принимающие участие в этом процессе, изображают точками вокруг химического знака.
Как валентность зависит от строения атома?
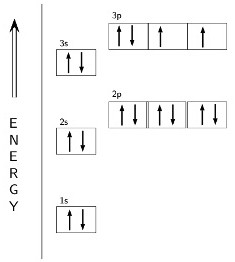
С помощью энергетической диаграммы можно показать строение уровней и подуровней (s, p, d), от которых зависит формула валентности серы. Две разнонаправленные стрелочки символизируют спаренные, одна — неспаренные электроны. Внешнее пространство атома серы образуют орбитали 6 частиц, а необходимо 8 для устойчивости по правилу октета. Конфигурацию валентной оболочки отражает формула 3s23p4. Электроны незавершенного слоя обладают большим запасом энергии, что вызывает неустойчивое состояние всего атома. Для достижения стабильности атому серы требуются две дополнительные отрицательные частицы. Они могут быть получены при образовании
ковалентных связей с другими элементами или за счет поглощения двух свободных электронов. В этом случае сера проявляет валентность II (–). Такое же значение можно получить, используя формулу: 8 – 6 = 2, где 6 — это номер группы, в которой находится элемент.
Где встречаются соединения, в которых валентность серы равна II (–)?
Элемент притягивает или полностью отнимает электроны у атомов с меньшим значением электроотрицательности по шкале Поллинга. Валентность II (–) проявляется в сульфидах металлов и неметаллов. Обширная группа подобных соединений встречается в составе
горных пород и минералов, имеющих огромное практическое значение. К ним относятся пирит (FeS), сфалерит (ZnS), галенит (PbS) и другие вещества. Кристаллы сульфида железа имеют красивый желтовато-коричневый цвет и блеск. Часто минерал пирит называют «золотом дураков». Для получения металлов из руд проводят их обжиг или восстановление. Сульфид водорода H2S имеет такую же электронную структуру, как вода. Происхождение H2S:
- выделяется при гниении белков (например, куриного яйца);
- извергается с вулканическими газами;
- накапливается в природных водах, нефти;
- выделяется в пустоты в земной коре.
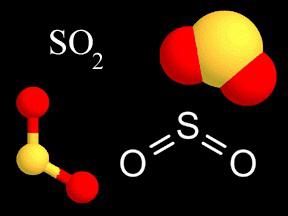
Почему формула оксида четырехвалентной серы SO2?
Формула диоксида показывает, что один атом серы в молекуле связан с двумя атомами кислорода, каждому из которых необходимо 2 электрона до октета. Возникшая связь является по своей природе ковалентной полярной (ЭО кислорода больше). Валентность серы в этом соединении имеет значение IV (+), потому что 4 электрона атома серы смещаются в сторону двух атомов кислорода. Формулу можно записать так: S2O4, но по правилам нужно сократить на 2. Диоксид при растворении в воде образует ионы слабой сернистой кислоты. Ее соли — сульфиты — сильные восстановители. Газ SO2 служит промежуточным продуктом в
производстве серной кислоты.В каких веществах сера проявляет свою высшую валентность?
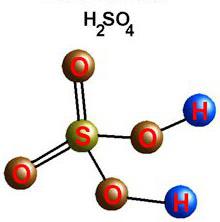
Оксид SO3 или S2O6 — бесцветная жидкость, при температурах ниже 17°С она твердеет. В соединении SO3 валентность кислорода равна II (–), а серы VI (+).
Высший оксид растворяется в воде и образует сильную двухосновную серную кислоту. За большую роль в производственных процессах вещество назвали «хлебом химической промышленности». Важная роль в хозяйстве и медицине принадлежит солям кислоты — сульфатам. Используются кристаллогидрат кальция (гипс),
натрия (глауберова соль), магния (английская или горькая соль).
В образовании разных типов химической связи могут участвовать 1, 2, 3, 4, 6 внешних электронов. Назовем возможные валентности серы, учитывая, что есть редкие и нестабильные соединения: I (–), II (–), II (+), III (+), IV (+), VI (+). Вторую положительную валентность элемент приобретает в монооксиде SO. Наиболее распространенные значения II (–), IV (+), VI (+) проявляет сера в составе группы веществ, имеющих промышленное, сельскохозяйственное и медицинское значение. Ее соединения используются в производстве фейерверков.
Большой проблемой остается улавливание отходящих газов, среди которых вредные для человека и окружающей среды оксиды серы IV (+), VI (+) и сероводород. Созданы технологии для переработки этих газообразных отходов и получения из них серной кислоты, сульфатов. С этой целью химические предприятия возводят рядом с металлургическими комбинатами или в одном районе. В результате объем загрязнений сокращается, меньше возникает «сернокислотных дождей».