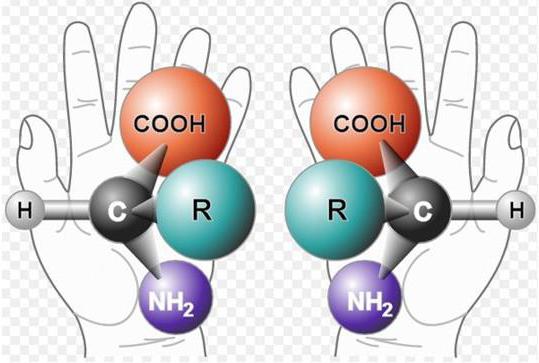
Молекулы белков представляют собой амфотерные основания, поскольку содержат свободные амино- и карбоксигруппы. При рН раствора меньше 7 они имеют отрицательный заряд, а при рН больше 7 - положительный. При равенстве данных зарядов, которое достижимо при установлении в растворе определенной кислотности или щелочности, устанавливается так называемая изоэлектрическая точка белка.
Понятие об изоэлектрической точке
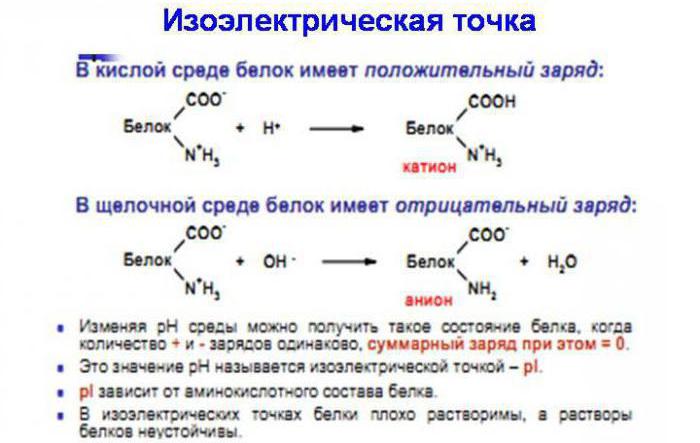
Белки состоят из аминокислот. Некоторые из этих соединений (аргинин, аспарагиновая кислота, гистидин, глутаминовая кислота, лизин) представлены в виде радикалов, содержащих ионогенные группы, то есть такие группы, которые способны к ионизации. Помимо них к ионизации способны альфа-карбоксильная и аминогруппы, расположенные на углеродном и азотном концах полипептидных цепей. Если рН раствора равен 7 или приближен к данной отметке, то в ионизированном состоянии находятся все ионогенные группы. По мере удаления от данного значения рН в ту или иную сторону, причем преимущественно в кислую, белок начинает переход в изоэлектрическое состояние, при котором молекула данного вещества становится электронейтральной, число ионизированных групп стремится к нулю. Величина рН, при которой белки переходят в изоэлектрическое состояние, называется изоэлектрической точкой белков (ИЭТ).

Физико-химическая природа белков
Из-за того, что в состав белков входят карбокси- и аминные группы, они могут диссоциировать как основания и как кислоты. Свободная карбоксильная группа при диссоциации отдает положительно заряженный ион водорода и анион COO-. В результате ион водорода присоединяется к аминогруппе, что характеризует основные свойства белка, в результате чего образуются частицы белка с отрицательным и положительным зарядами. При помещении белка в кислый раствор его кислотная диссоциация будет подавляться из-за значительного присутствия катионов водорода. И наоборот, при помещении его в основный раствор его основная диссоциация будет подавляться из-за присутствия анионов COO-.
Пропускание через белковый раствор электрического тока приведет к тому, что анионы начнут двигаться к катоду, а катионы - к аноду. В любом белке есть определенная величина рН, при которой движение ионов при пропускании тока не будет происходить. В этом случае говорят о равенстве разнонаправленных ионов и равенстве различных степеней (основной и кислой) в белковой молекуле, что характеризуется изоэлектрическим состоянием.
Как известно, вода представляет собой диполь, поэтому она располагает свои частицы вокруг белковой молекулы в зависимости от того, как она заряжена. В изоэлектрической точке молекула белка не имеет гидратно-ориентированной оболочки. Если осуществляется осаждение белков, необходимо, прежде всего, разрушить гидратную оболочку, сняв электрический заряд.
Использование ИЭТ в промышленности
В изоэлектрическом состоянии некоторые свойства раствора белка, такие как набухание, вязкость, осмотическое давление, светопропускание, имеют минимальные значения, при этом показатель преломления и оптическая плотность достигают, наоборот, максимальной величины. Изоэлектрическую точку белка можно определить опытным путем, определяя зависимость указанных выше свойств белкового раствора: от величины рН, при этом по положению экстремумов на графиках определяют ИЭТ. В изоэлектрическом состоянии казеин способен осаждаться, что применяется при производстве сыров и кисломолочных продуктов, для получения казеина из обезжиренного молока, как сырья в различных производствах (казеиновые клеи, искусственные продукты питания и т. д.). Измерение ИЭТ позволяет оценить качество белка, в частности, молочного продукта на наличие примесей. Это актуально на сегодняшний день, поскольку введение растительных добавок в молочную основу позволяет заменить часть животного белка растительным, который является более дешевым.
Помимо этого, изоэлектрическая точка белка может использовать при очистке сточных вод от птицефабрик. Так, основная доля загрязнений сточных вод убойного цеха птицефабрики приходится на белки крови. Учитывая то, что ИЭТ большинства белков находится в зоне слабокислой реакции среды, наиболее полное извлечение белков будет происходить при слабокислой реакции среды при величине рН, стремящейся к ИЭТ.
Факторы, оказывающие влияние на ИЭТ

На ИЭТ оказывает влияние несколько факторов. Рассмотрим, от чего зависит изоэлектрическая точка белков. Прежде всего, она определяется преобладанием аминных или карбоксигрупп в составе молекулы белка. Большая часть белков представляют собой более сильные кислоты по сравнению с основаниями, поэтому для них ИЭТ меньше 7. Имеется группа белков, которые являются более сильными основаниями, чем кислотами, для них ИЭТ больше 7. Установлена сильная корреляционная зависимость между изоэлектрической точкой белка и содержанием ионов солей в растворе. Концентрация белка не оказывает никакого влияния на данный показатель. Рассмотренные факторы позволяют понять, почему изоэлектрическая точка различна для разных белков.
Примеры ИЭТ белков:
- пепсин имеет значение ИЭТ около 1;
- казеин и желатин - 4,7;
- яичный альбумин - 4,8;
- муцин - 2,7;
- пепсиноген - 3,7;
- альбумины - 4,6;
- инсулин - 5,3;
- оксигемоглобин - 6,8;
- карбоксигемоглобин - около 6,9;
- миоглобин - 7,0;
- химотрипсин - 8,6;
- цитохром С - 10,5;
- сальмин - 12.
ИЭТ и ее определение
Все методы определения изоэлектрической точки белков основаны на приготовлении буферных растворов, имеющих отличающуюся реакцию среды. Во все эти растворы помещаются одинаковые навески изучаемого белка, который может быть как в сухом виде, так и в виде раствора. Используются различные методы определения ИЭТ. Как определить изоэлектрическую точку белка?
Основными методами определения ИЭТ являются электрофорез, по минимуму вязкости и связанный с применением водоотнимающих веществ. Могут использоваться и некоторые другие методы, такие, как определение по степени набухания сухого белка, скорости застудевания, но они менее точные и требуют наличия большого количества белка.
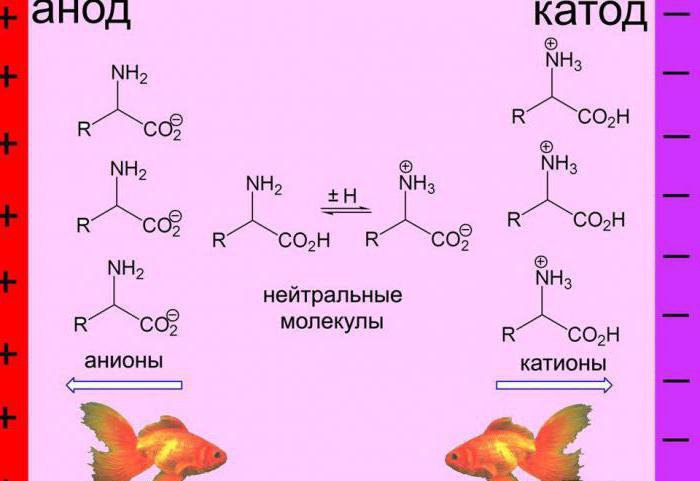
Электрофорез
При использовании данного метода в прибор для его осуществления помещаются полоски хромотографической или фильтровальной бумаги, смоченные определенным буферным раствором. Посередине каждой полоски делается карандашная отметка, в которую при помощи пипетки наносится одна капля изучаемого раствора белка. Затем прибор включают и через эти полоски пропускают электрический ток. Макромолекулы изменяют свой заряд в зависимости от величины рН буферного раствора. Если величина рН превышает ИЭТ, то наблюдается отрицательный заряд макромолекул, и наоборот.

Если рН равно ИЭТ, то макромолекулы становятся нейтрально заряженными. Через определенное время подача тока прекращается, полоски бумаги достаются из прибора и высушиваются, после чего пятна белка опрыскивают нингидрином для их проявления. ИЭТ устанавливают по буферному раствору полоски бумаги, где белковое пятно осталось там же, где была нанесена капля. При необходимости этот метод может быть применен и для тонкого фракционирования белков.
Применение других методов для определения ИЭТ
При нахождении в изоэлектрическом состоянии молекулы белков менее гидратированы, поэтому изоэлектрическую точку белка можно определить, используя метод по минимуму вязкости. Для его применения необходимо наличие вискозиметра. С помощью этого прибора определяют относительную вязкость буферных растворов. Молекулы белка, находящегося в изоэлектрическом состоянии, свернуты, поэтому самая небольшая вязкость будет у раствора, в котором его рН будет совпадать с ИЭТ.
На этом же свойстве основан метод, связанный с действием водоотнимающих средств. В качестве таких средств могут выступать ацетон, эфир или спирт. Выделение белков из соответствующих растворов потенциально происходит тем быстрее и полнее, чем полнее соответствует реакция среды ИЭТ. В изоэлектрической точке растворы белков неустойчивы.
Таким образом, существуют различные методы определения изоэлектрической точки белка. И ее определение должно выполняться в зависимости от имеющегося оборудования, материалов, количества белка.
Устойчивость белка в ИЭТ
В изоэлектрической точке белка силы отталкивания между белковыми частицами в макромолекуле ослабевают, благодаря чему происходи агрегация этих молекул и белок выпадает в осадок. Это свидетельствует о том, что в ИЭТ белок неустойчивый за счет потери заряда, который является фактором стабилизации водных белковых растворов. Если к белку добавить кислоту или основание, то молекулы перезаряжаются, белок осуществляет переход в раствор.
В заключение
Таким образом, изоэлектрическая точка белка представляет собой значение реакции среды (рН), при котором в белковой молекуле отмечается равенство разнонаправленных (отрицательных и положительных) зарядов и равенство различных степеней (основных и кислотных) диссоциации. В данной точке белок теряет заряды и становится неустойчивым, вследствие чего выпадает в осадок. Молекула белка сворачивается, в то время, когда она несет в себе определенные заряды, она распрямлена в виде нити.


























