"Рождающие соли" – так переводится название элементов, о свойствах которых пойдет речь в нашей статье. Находясь в VII А группе периодической системы химических элементов, они представляют собой наиболее активные неметаллы. Особенности строения атомов обуславливают как физические свойства галогенов, так и их способность к реакциям с металлами, водородом и другими неметаллическими элементами. Рассмотрим их подробнее.
Как положение в периодической системе влияет на строение атома
Отличительной чертой галогенов является их ярко выраженная электроотрицательность – способность забирать единичные отрицательно заряженные частицы у атомов менее активных элементов.
В этом случае электронные оболочки фтора, хлора, брома и йода заполняются электронами до октета и становятся устойчивыми анионами: F-, CI- и т. д. Атомы металлов при взаимодействии с элементами VII A группы отдают свои частицы, превращаясь в положительно заряженные катионы, а в молекулах образовавшихся солей, например хлорида натрия, фторида магния или йодида кальция, возникает прочная ионная связь. Простое вещество – галоген - представляет собой двухатомную молекулу, например CI2 или F2, содержащую между атомами ковалентную неполярную связь.
Изменение свойств веществ в VII А группе химических элементов
С увеличением заряда ядра и раздуванием атома за счет добавления новых энергетических слоев, электроотрицательность у галогенов уменьшается. Действительно, фтор является самым активным неметаллом и всегда имеет отрицательный заряд иона, т. е. он при взаимодействии с атомами других элементов забирает их электроны. Хлор в реакциях с веществами также электроотрицателен, за исключением оксидов, где его атом имеет положительную степень окисления. Физические свойства галогенов и их агрегатное состояние также изменяются с увеличением заряда ядра. Остановимся на этом вопросе подробнее.

От газа до кристалла
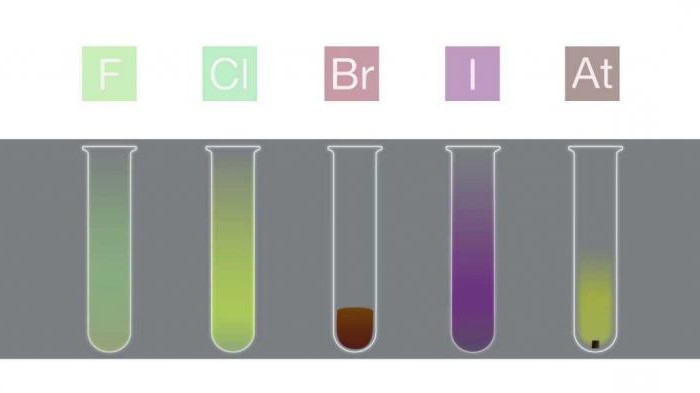
Простые вещества фтор и хлор представляют собой сильно токсичные газы. В малых концентрациях они вызывают раздражение слизистых оболочек глаз и верхних дыхательных путей. Длительное вдыхание паров галогенов приводит к параличу дыхательных мышц и удушью с летальным исходом. Именно поэтому немецкая армия в Первой мировой войне использовала хлор в качестве химического оружия.
С увеличением заряда ядра атома агрегатное состояние веществ изменяется, и бром уже представляет собой тяжелую жидкость красно-бурого цвета с резким запахом. Она может вызывать ожоги на коже, и особенно опасна при попадании в глаза.
Продолжим далее характеристику галогенов и остановимся на йоде и астате. Йод представлен в виде серо-фиолетовых кристаллов, плотность их - 4,94 г/см3. Вещество имеет низкую температуру плавления – 113,5° и при нагревании сразу же превращается в газ, минуя жидкую фазу. Такое явление в химии получило название сублимации.
Астат является радиоактивным элементом, по внешнему виду похожим на йод и так же, как он, способным к возгонке. В лаборатории его получают облучением атомов висмута ядрами атома гелия. Астат является наиболее редко встречающимся элементом в природе.

Особые свойства фтора
Рассмотрев физические свойства галогенов, остановимся на их способности реагировать с другими веществами. Интересным в этом отношении является фтор. Это первый элемент, который оказался способным образовывать соединения с инертными газами, в частности с ксеноном. Были получены несколько веществ – фторидов ксенона с различными степенями окисления инертного элемента: XeF2, XeF4, XeF6. С этого момента началось активное развитие химии благородных газов.
Другой галоген, формула которого CI2, - хлор - является вторым по активности элементом после фтора. Он взаимодействует с кислородом и образует несколько оксидов, в которых имеет такие степени окисления: +3, +5, +7. Как и все неметаллы, хлор реагирует с металлами, образуя соли – хлориды. Соединения хлора достаточно распространены в природе и входят в состав многих горных пород и минералов.
Распространенность неметаллов
Галогены в природе встречаются достаточно часто. В периоды вулканической активности большое количество газообразных соединений хлора, фтора и йода попадают в атмосферу Земли. Кроме того, как мы говорили ранее, хлориды представлены в виде рудообразующих соединений: сильвинита ( двойная соль KCI × NaCI), карналлита и поваренной соли. Отметим также, что хлор составляет примерно 0,05 % массы земной коры. Все элементы этого ряда, за исключением астата, не только входят в состав неживой природы, но и являются обязательными компонентами клеток растений, животных и человека.

Какие элементы входят в состав клеточных органелл
Биохимия – это наука, определяющая роль химических веществ в метаболических процессах, проходящих в живой клетке. Она подтверждает важное биологическое значение галогенов. Как оказалось, наибольшее распространение у прокариотов и эукариотов имеет хлор. Он является необходимым макроэлементом в цитоплазме и в межклеточной жидкости. Так, ионы хлора входят в состав плазмы крови, участвуют в транспорте веществ через клеточную мембрану, они также задействованы в процессах прохождения импульсов по нервному волокну. Атомарный фтор является компонентом эмали зубов, обеспечивая ее твердость и устойчивость к кариесу. Рассматривая физические свойства галогенов, выясним их значение в клеточном метаболизме.
Роль элементов VII А группы в обмене веществ
Бром и йод входят в комплексы биологически активных соединений: ферментов и гормонов. Например, трийодтиронин и тироксин, вырабатываемые тканями щитовидной железы и содержащие ионы йода, регулируют важнейшие процессы обмена веществ в организме человека. Их недостаточная секреция может вызвать такие тяжелые эндокринные патологии, как эндемический зоб или базедова болезнь. Основные источники поступления брома и йода в организм – это пищевая соль (хлорид натрия), морские водоросли, например такие, как ламинария (она содержит йод и бром), морепродукты.
Получение галогенов
Классическим примером, известным еще из школьного курса химии, является лабораторный опыт выделения свободного хлора из соляной кислоты действием на нее диоксида марганца при нагревании. Реакция обязательно проводится в вытяжном шкафу вследствие высокой токсичности газообразного хлора. Если в качестве окислителя использовать перманганат калия, то процесс можно проводить без нагревания реагентов. Фтор, хлор, бром и йод имеют широкое применение в химии органического синтеза, в фармакологии и медицине, поэтому получение галогенов проводится в промышленных масштабах методом электролиза. Чтобы выделить молекулы CI2 , используют электолизеры с концентрированным раствором хлорида натрия.

Хлор восстанавливается на аноде, его собирают, а затем сжижают под давлением до 6 атмосфер и при комнатной температуре. Для транспортировки полученного продукта используют стальные баллоны. Фтор, бром и йод также получают методом электролиза. Но при этом используют не растворы, а расплавы их солей.
Где и как используют неметаллы
Как простые вещества, так и соединения хлора, фтора, брома и йода имеют большое значение в жизни человека. Например, применение галогенов в медицине обусловлено бактерицидными свойствами спиртового раствора йода и хлорной извести. Последнее вещество можно использовать в проведении карантинных мероприятий, при очистке воды и дегазации зараженной территории. Высокие окислительные свойства хлора позволяют применять его в качестве отбеливателя ткани и бумаги.

Простое вещество также используют в промышленном производстве соляной кислоты. Фтор – незаменимый компонент в синтезе фторопластов, вследствие высокой химической активности им окисляют ракетное топливо. Бром входит в состав многих лекарственных средств, применяемых в неврологии для купирования судорожных состояний, при нервном истощении и бессоннице. Все выше приведенные примеры являются наглядным подтверждением того, какое важное значение для человека имеет применение галогенов в промышленности и быту.


























