Прежде чем исследовать микроорганизмы под микроскопом, изучаемый образец подвергают специальной подготовке. В естественном виде практически все бактерии прозрачны, поэтому их окрашивают красителями. Окрашивание позволяет определить как морфологические свойства исследуемых микробов, так и принадлежность их к тому или иному виду. Способность микроорганизмов воспринимать красители называется тинкториальными свойствами. С их помощью биологи определяют вид микроба, его параметры, особенности структур, а также выявляют возбудителей инфекционных заболеваний. Из этой статьи вы подробнее узнаете, что это – тинкториальные свойства, а также как их используют в науке.
Задачи, которые решает метод окрашивания
Первым делом давайте выясним, в чем значение тинкториальных свойств микроорганизмов. Окрашивание образца является одной из ключевых техник микробиологии, позволяющих изучить как внешнее, так и внутреннее строение организмов. Бактерии являются полупрозрачными микроорганизмами, преломляющими лучи света. Поэтому при обычном микроскопировании их нельзя рассмотреть. Разные части бактерии по-разному взаимодействуют с красителем. Тинкториальные свойства – это отличная возможность для исследователей. Будучи разными у различных микроорганизмов, они позволяют определить их важнейшие характеристики: форму, размер, строение, локализацию и прочее.

Подготовка образца и его окраска
Независимо от того, какую методику окрашивания практикует исследователь, данная процедура состоит из ряда обязательных стадий:
- Приготовление образца. В каплю воды, размещенную на предметном стекле, с помощью бактериологической петли вносят изучаемый материал.
- Сушка мазка. Проводится при комнатной температуре, либо в потоке теплого воздуха (но не слишком близко к источнику тепла).
- Фиксация. Предполагает закрепление микроорганизмов на стекле, с целью усиления их восприимчивости к окрашиванию.
- Окраска. На исследуемый образец наносят краситель и дают ему какое-то время постоять. Затем остатки красителя удаляют и промывают образец водой.
- Сушка. Заключительная стадия, позволяющая избавиться от остатков воды после промывки. После сушки образец готов к изучению под микроскопом.
Распространенные красители
Окрашивание образцов проводят с помощью анилиновых красителей, с разным показателем кислотности (рН). Их подразделяют на: основные (ударение на вторую букву о), кислотные и нейтральные.
В основных красителях действующим агентом выступает катион. С помощью различных реагентов можно получить разные цвета окрашивания микробов:
- Красный – пиронин, сафранин, нейтральрот, фуксин основной.
- Фиолетовый – тионин, метил-, генциан- и кристаллвиолет.
- Синий – метиленовая синь и виктория.
- Зеленый – малахитовая и метиленовая зелень.
- Черный – индулин.
- Коричневый – везувин и хризоидин.
В кислотных красителях красящими свойствами наделен анион. Из них наиболее распространены:
- Красный – кислый фуксин и эозин.
- Черный – нигрозин.
- Желтый – пикроновая кислота.
Нейтральные красители могут окрашивать как анионы, так и катионы. В качестве яркого примера таковых можно назвать родамин В.
Существующие методы окрашивания, основанные на тинкториальных свойствах микроорганизмов, можно разделить на три главных типа: витальный, поствитальный и окрашивание спор. На каждом из этих методов остановимся подробнее.
Витальный способ
Данный метод также называется прижизненным, следовательно, окрашивание производится с целью микроскопирования живых организмов. Введение красящего препарата позволяет исследовать особенности внутриклеточных структур и тканей. Есть также методики витального окрашивания, предполагающие умерщвление образца сразу после окраски.
Для прижизненного окрашивания используют специальные красители, отличающиеся низкой токсичностью и высокой проникающей способностью. Кроме витальных препаратов, для решения этой задачи применяют также флуорохромы или флуоресцентные красители.
Поствитальный способ
В отличие от предыдущего варианта, здесь окрашивание производят после умерщвления микроорганизмов. Методы поствитального окрашивания подразделяют на простые и сложные. Простые позволяют определить морфологические свойства исследуемых организмов: форму, размер, локализацию, взаиморасположение. Сложные же методы являются узконаправленными и позволяют получить сведения о структуре микроорганизма. Чаще всего сложные способы окрашивания носят имена своих создателей. Из них наибольшей популярностью пользуются следующие методики.
Метод Грама. Способ, разработанный еще в конце 19 века, базируется на дифференциации микробов по проницаемости клеточных стенок. С помощью обработки образца анилиновыми красителями (генциановым фиолетовым или метиловым) и последующей промывки исследователь получает два типа микробов: грамположительные (характерная синяя окраска) и грамотрицательные (обеспеченные). Для того чтобы получить более полную картину, используется также красный краситель, после обработки которым даже грамотрицательные микроорганизмы приобретают окраску – от розовой до красной.
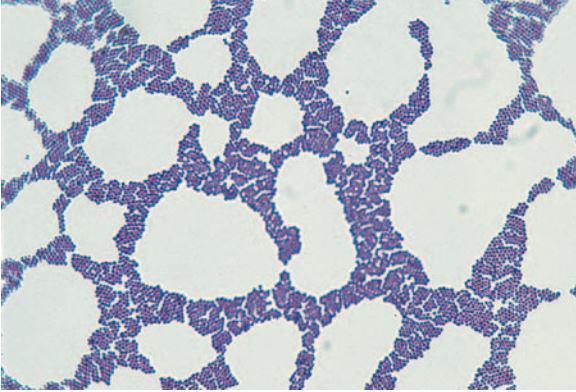
Методика Грама позволяет классифицировать микробы и провести их разделение по тинкториальным свойствам. Это один из наиболее простых и распространенных методов подготовки образца для микроскопирования. Прикладное значение данной методики заключается в диагностике различных инфекционных заболеваний.
Метод Циля-Нильсена. Этот способ был разработан также в конце XIX века. Он основывается на определении кислотоустойчивости бактерий с помощью окрашивания. Этим методом, благодаря тинкториальными свойствам микроорганизмов, можно выявить возбудители туберкулеза, лепры и микобактериоза.
Методика Романовского-Гимзе. Этот способ был разработан уже в начале двадцатого века. Его суть состоит в том, что после окрашивания образца специальным красителем ацидофильные бактерии приобретают различные оттенки красного цвета, а базофильные – от пурпурного до синего.
Ацидофилами называют молочно- и уксуснокислые бактерии, для жизнедеятельности которых необходима низкая кислотность среды. Базофилы же представляют собой микробов, которые могут быть окрашены основными красителями. Таким образом, метод базируется на разделении микробов по значению кислотности среды. Его широко применяют в изучении морфологии простейших и спирохет.
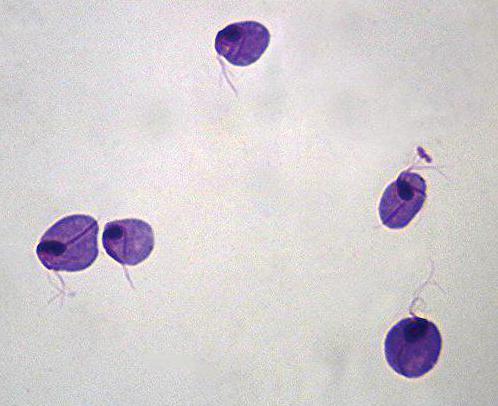
Методика Бурри-Гинса. Позволяет определить наличие у бактерий капсул.
Метод Морозова. Данный способ окраски дает возможность сделать жгутики бактерий видимыми. Для этого необходимо произвести такие манипуляции:
- Обработать образец кислотой, чтобы жгутики разрыхлились.
- Зафиксировать разрыхленные ткани танином.
- Окрасить образец азотнокислым серебром.
В результате бактерия, со всеми своими жгутиками, становится видимой. Ее цвет может колебаться от желтого до коричневого.
Окрашивание спор
Тинкториальные свойства микроорганизмов позволяют с помощью окраски сделать заметными их споры. Для этого чаще всего используют методику Циля-Нильсона. Ее суть состоит в обработке исследуемого образца фуксином Циля и его дальнейшем обесцвечивании с помощью однопроцентной серной кислоты. В результате споры окрашиваются в розовый цвет и хорошо выделяются на фоне синей бактерии.
Получить видимую картину спор позволяет также методика Ожешко. Согласно этому методу, оболочки спор сначала протравливают при высокой температуре кислотой, а затем используют окрашивание по Цилю-Нильсону.

Структурные особенности микробов
Клетка микроорганизма обычно состоит их стенок (оболочка), цитоплазматической мембраны, цитоплазмы, содержащей в своем составе нуклеотид и включения. Некоторые разновидности микробов также обладают жгутиками, фимбриями или ресничками, и могут образовывать капсулы или споры.
Оболочка микроорганизма обусловливает его форму, а также защищает его от неблагоприятной окружающей среды и осмотического внутреннего давления. Стенки микробов имеют довольно сложные химический состав и структуру. У грамположительных и грамотрицательных клеток они отличаются. Первые имеют толстую клеточную стенку, содержащую тейхоевые кислоты и немного липидов. Стенка вторых состоит их полипептидного и полисахаридного слоев.
Снаружи клеточная стенка покрывается слизистым слоем. У некоторых микробов он может увеличиваться (набухать) образуя капсулу, состоящую преимущественно из полисахаридов, а иногда, полипептидов. Она маловосприимчива к окрашиванию. Именно поэтому такие микробы изучают с помощью метода Бурри-Гинса. У некоторых патогенных микробов (к примеру, пневмококка) капсула образуется только в организмах животных либо человека.
При исследовании микробов под микроскопом внимание также обращается на окрашиваемость цитоплазмы и ее структур. Цитоплазма может окрашиваться гомогенно (однородно) или гетерогенно (присутствуют включения органической или неорганической природы). Для изучения включений используют специальные методики окрашивания (например, по Нейссеру). Кроме того, в составе цитоплазмы определяют наличие ядра или нуклеотида.
Узнав, что это – тинкториальные свойства и то, как они помогают в микроскопировании, рассмотрим особенности некоторых распространенных микробов.
Стрептококки
С точки зрения тинкториальных свойств стрептококки являются грамположительными микроорганизмами, поэтому их определяют по методу Грама. Наиболее яркое окрашивание этих бактерий происходит при воздействии синькой Лаффера. Структура расположения их клеток напоминает цепочку.
Сальмонеллы
Представляют собой факультативные анаэробы, большинство из которых подвижно благодаря наличию жгутиков. На плотной питательной среде сальмонеллы собираются в круглые бело-серые колонии. Спор не образуют, имеют перитрихи и микрокапсулу. Как и стрептококки, сальмонеллы окрашиваются по методу Грама. Разница заключается в том, что по своим тинкториальным свойствам сальмонеллы грамотрицательны.
Менингококки
Имеют округленную полиморфную форму. На питательной среде располагаются попарно. Тинкториальные свойства менингококков таковы, что они грамотрицательны, однако на окраску по Граму реагируют недостаточно четко. Неравномерное окрашивание обуславливается тем, что чем старее клетка, тем слабее ее тинкториальные свойства. Жгутиков менингококки не имеют, а спор не образуют.
Холерный вибрион
Данный микроб имеет один полярный жгутик, который снабжен чехликом и ундулирующей мембраной. Холерный вибрион имеет выраженную подвижность. Для него характерен полиморфизм. Тинкториальные свойства холерного вибриона обуславливают его окрашивание анилиновыми красителями. Как правило, это водный фуксин Пфейфера или карболовый фуксин Шля.
Кишечная палочка
Представляет собой факультативный анаэроб, не образующий спор. Клетки имеют форму палочек с закругленными концами. Тинкториальные свойства кишечной палочки относят ее к грамотрицательным бактериям. Штаммы бактерий с перитрихально расположенными жгутиками могут передвигаться.
Нейтрофилы
Такое название микробы получили благодаря своим тинкториальным свойствам. Нейтрофилы могут интенсивно окрашиваться по методу Романовского, как основными красителями, так и кислотным эозином. Взрослые бактерии имеют сегментированное ядро, а значит, относятся к полиморфонуклеарам. Они наделены адгезивностью, подвижностью, а также способностью к хемотаксису и захвату частиц. Вместе с базофилами и эозинофилами относятся к гранулоцитам.
Базофилы
По аналогии с предыдущими микробами, эти бактерии получили свое название благодаря тинкториальным свойствам. Базофилы интенсивно окрашиваются основным красителем и совсем не окрашиваются кислым эозином. Они имеют крупные гранулоциты и содержат много: гистамина, серотонина, простагландинов, лейкотриенов и прочих медиаторов воспалительных и аллергических процессов.
Эозинофилы
В отличие от двух предыдущих гранулоцитов, эти микробы интенсивно окрашиваются только кислым красителем, и вовсе не окрашиваются основными препаратами. Эозинофилы наделены способностью к экстравазации, хемотаксису и амебоидному движению. Они могут поглощать и связывать ряд медиаторов воспалительных и аллергических реакций.