Если взглянуть на хронологию изучения в химической науке способности атомов различных элементов к взаимодействию между собой, то можно выделить середину XIX столетия. В это время ученые обратили внимание на то, что водородные соединения кислорода, фтора, азота характеризуются группой свойств, которые можно назвать аномальными.
Это прежде всего очень высокие температуры плавления и кипения, например у воды или фтороводорода, которые являются большими, чем у других похожих соединений. В настоящее время уже известно, что эти особенности указанных веществ определяются свойством водородных атомов образовывать необычный тип связи с атомами элементов, имеющими высокий показатель электроотрицательности. Ее назвали водородной. Свойства связи, специфика ее образования и примеры соединений, содержащих ее, – вот главные моменты, на которых мы остановимся в нашей статье.
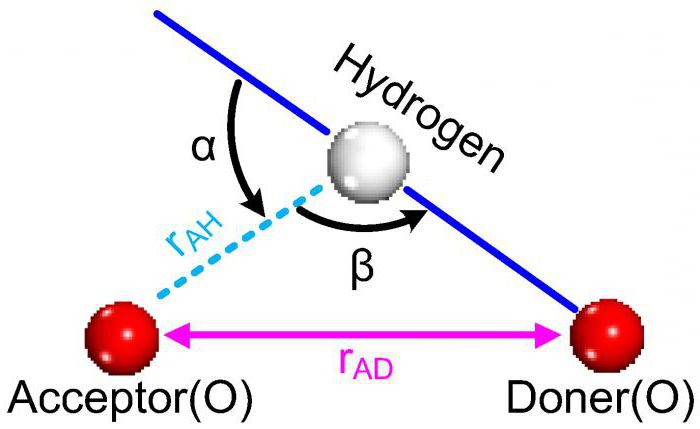
Причины возникновения связи
Действие сил электростатического притяжения – это физическая основа появления большинства видов химической связи. Типы химических связей, возникших благодаря взаимодействию противоположно заряженных атомных ядер одного элемента и электронов другого, хорошо известны. Это ковалентная неполярная и полярная связи, характерные для простых и сложных соединений неметаллических элементов.
Например, между атомом фтора, у которого электроотрицательность наибольшая, и электронейтральной частицей водорода, одноэлектронное облако которой вначале принадлежало только атому H, происходит смещение отрицательно заряженной плотности. Теперь сам атом водорода можно по праву назвать протоном. Что же происходит далее?
Электростатическое взаимодействие
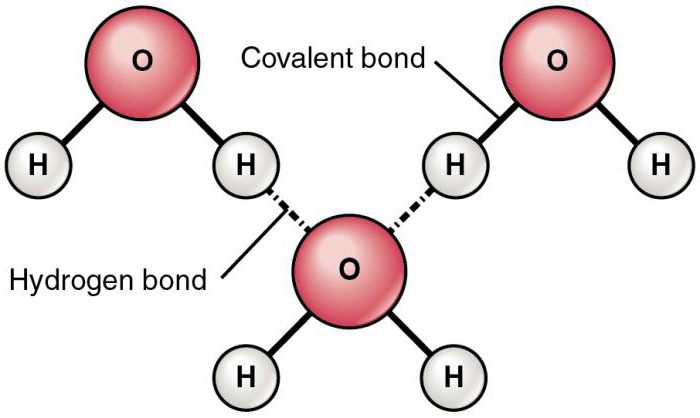
Электронное облако водородного атома практически полностью переходит в сторону частицы фтора, и та приобретает избыточный негативный заряд. Между оголенным, то есть лишенным негативной плотности, атомом водорода – протоном, и ионом F- соседней молекулы фтороводорода проявляется сила электростатического притяжения. Она приводит к появлению межмолекулярной водородной связи. Благодаря ее возникновению, сразу несколько молекул HF могут образовывать устойчивые ассоциаты.
Главным условием формирования водородной связи является наличие атома химического элемента, имеющего высокую электроотрицательность, и взаимодействующего с ним протона водорода. Наиболее ярко этот тип взаимодействия проявляется в соединениях кислорода и фтора (вода, фтористый водород), меньше – в азотсодержащих веществах, например аммиаке, и еще меньше – у соединений серы и хлора. Примеры водородной связи, образующейся между молекулами, можно встретить и у органических веществ.
Так, у спиртов между атомами кислорода и водорода функциональных гидроксильных групп также возникают силы электростатического притяжения. Поэтому уже первые представители гомологического ряда – метанол и этиловый спирт - являются жидкостями, а не газами, как другие вещества такого состава и молекулярной массы.
Энергетическая характеристика связи
Сравним между собой энергоемкость ковалентной (40–100 ккал/моль) и водородной связи. Примеры, приведенные далее, подтверждают следующее утверждение: водородный тип содержит всего от 2 ккал/моль (между димерами аммиака) до 10 ккал/моль энергии в соединениях фтора. Но ее оказывается достаточно для того, чтобы частицы некоторых веществ смогли связываться в ассоциаты: димеры, тетра - и полимеры – группы, состоящие из многих молекул.
Они находятся не только в жидкой фазе соединения, но могут сохраняться, не распадаясь, при переходе в состояние газа. Поэтому водородные связи, обеспечивающие удерживание молекул в группах, служат причиной аномально высоких температур кипения и плавления аммиака, воды или фтороводорода.
Как происходит ассоциация молекул воды
Как неорганические, так и органические вещества имеют несколько типов химической связи. Химическая связь, возникающая в процессе ассоциации полярных частиц между собой, и называемая межмолекулярной водородной, может коренным образом изменять физико-химическую характеристику соединения. Докажем это утверждение, рассматривая свойства воды. Молекулы H2O имеют вид диполей – частиц, полюса которых несут противоположные заряды.
Соседние молекулы притягиваются друг к другу положительно заряженными протонами водорода и отрицательными зарядами атома кислорода. В результате этого процесса образуются молекулярные комплексы - ассоциаты, приводящие к появлению аномально высоких температур кипения и плавления, большой теплоемкости и теплопроводности соединения.
Уникальные свойства воды
Присутствие водородных связей между частицами H2O является причиной многих ее жизненно важных свойств. Вода обеспечивает важнейшие реакции обмена веществ – гидролиз углеводов, белков и жиров, протекающий в клетке, - и является растворителем. Такую воду, входящую в состав цитоплазмы или межклеточной жидкости, именуют свободной. Благодаря водородным связям между молекулами, она образует гидратные оболочки вокруг белков и гликопротеидов, которые предотвращают слипание между макромолекулами полимеров.
В этом случае воду называют структурированной. Приведенные нами примеры водородной связи, возникающей между частицами H2O, доказывают ее ведущую роль в формировании основных физических и химических свойств органических веществ – белков и полисахаридов, в процессах ассимиляции и диссимиляции, протекающих в живых системах, а также в обеспечении их теплового баланса.
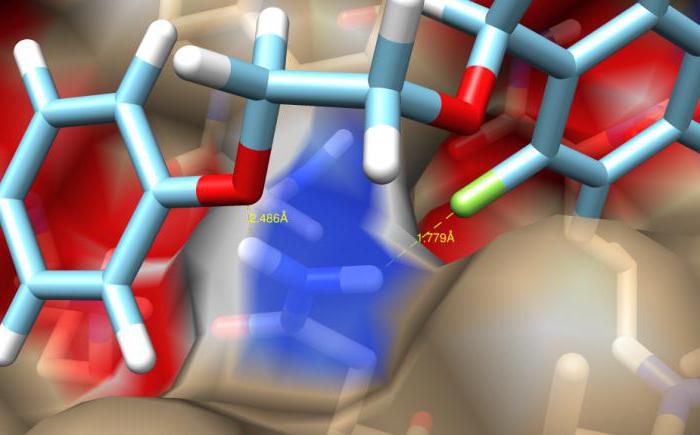
Внутримолекулярная водородная связь
Салициловая кислота - одно из хорошо известных и давно применяемых в медицине лечебных средств, обладающих противовоспалительным, ранозаживляющим и антимикробным эффектом. Сама кислота, бромопроизводные фенола, органические комплексные соединения способны формировать внутримолекулярную водородную связь. Примеры, приведенные далее, показывают механизм ее образования. Так, в пространственной конфигурации молекулы салициловой кислоты возможно сближение атома кислорода карбонильной группы и протона водорода гидроксильного радикала.
Вследствие большей электроотрицательности кислородного атома, электрон частицы водорода практически полностью попадает под влияние ядра кислорода. Внутри молекулы салициловой кислоты возникает водородная связь, которая повышает кислотность раствора вследствие увеличения концентрации в нем ионов водорода.
Подводя итог, можно сказать, что данный тип взаимодействия между атомами проявляется в случае, если группа донора (частицы, отдающей электрон) и атома акцептора, принимающего его, входят в состав одной и той же молекулы.


























