Есть такое соединение: винная кислота. Она является отходом винодельческой промышленности. Изначально винная кислота содержится в виноградном соке в виде своей кислой натриевой соли. Однако в процессе брожения сахар под действием специальных дрожжей превращается в спирт, и от этого растворимость соли винной кислоты падает. Тогда она выпадает в осадок, который называют винным камнем. Ее кристаллизуют, подкисляют и, в конце концов, получают саму кислоту. Однако с ней не все так просто.
Пастер
На самом деле в растворе содержатся две кислоты: винная и другая, виноградная. Они различаются тем, что винная кислота обладает оптической активностью (вращает плоскость поляризованного света вправо), а виноградная – нет. Луи Пастер исследовал это явление и установил, что кристаллы, образуемые каждой из кислот, являются зеркальным отражением друг друга, то есть предположил связь между формой кристаллов и оптической активностью веществ. В 1848 году он после серии экспериментов заявил о новом виде изомерии винных кислот, который назвал энантиомерией.
Вант-Гофф
Якоб Вант-Гофф ввел понятие так называемого асимметрического (или хирального) атома углерода. Это такой углерод, который в органической молекуле связан с четырьмя различными атомами. Например, в винной кислоте второй атом в цепочке имеет в соседях карбоксильную группу, водород, кислород и второй кусок винной кислоты. Поскольку в такой конфигурации углерод располагает свои связи в форме тетраэдра, можно получить два соединения, которые будут являться зеркальными отражениями друг друга, но «наложить» их одно на другое, не меняя порядка связей в молекуле, будет невозможно. Кстати, такой способ определять хиральность – это предложение лорда Кельвина: отображение группы точек (в нашем случае точки – атомы в молекуле), обладающих хиральностью, в идеальном плоском зеркале не может быть совмещено с самой группой точек.
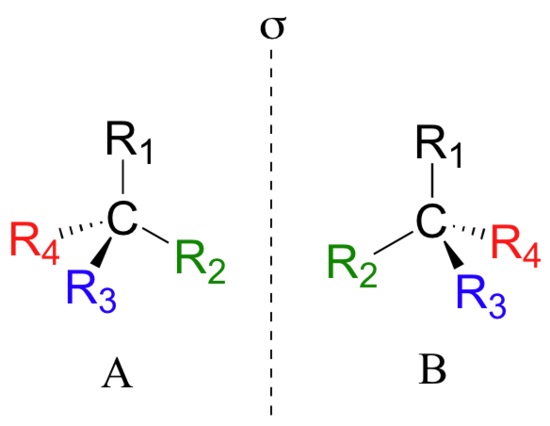
Симметрия молекул
Объяснение с зеркалом выглядит просто и красиво, но в современной органической химии, где исследуются молекулы действительно огромные, этот умозрительный метод связан со значительными трудностями. Поэтому обращаются к математике. Точнее, к симметрии. Существуют так называемые элементы симметрии – ось, плоскость. Мы крутим-вертим молекулу, оставляя элемент симметрии неподвижным, и молекула после поворота на определенный угол (360°, 180° или еще как-нибудь) начинает выглядеть точно так же, как и вначале.
И тот самый асимметрический атом углерода, введенный Вант-Гоффом, есть основа самого простого вида симметрии. Этот атом – хиральный центр молекулы. Он тетраэдрический: имеет четыре связи с разными заместителями на каждой. И поэтому, проворачивая соединение по оси, содержащей такой атом, мы получим идентичную картинку только после полного поворота на 360°.
Вообще, хиральным центром молекулы может являться не только один атом. Например, есть такое интересное соединение – адамантан. Он похож на тетраэдр, у которого каждое ребро дополнительно выгнули наружу, и в каждом углу – атом углерода. Тетраэдр симметричен относительно своего центра, и молекула адамантана – тоже. И если в четыре одинаковых «узла» адамантана добавить четыре разных заместителя, то он тоже обретет точечную симметрию. Ведь если поворачивать его относительно своего внутреннего «центра тяжести», картинка совпадет с начальной только через 360°. Здесь вместо асимметрического атома роль хирального центра играет «пустой» центр адамантана.
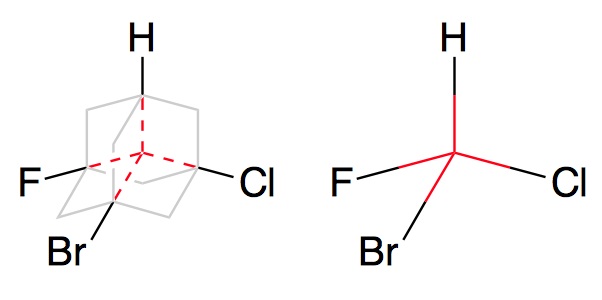
Стереоизомеры в биоорганических соединениях
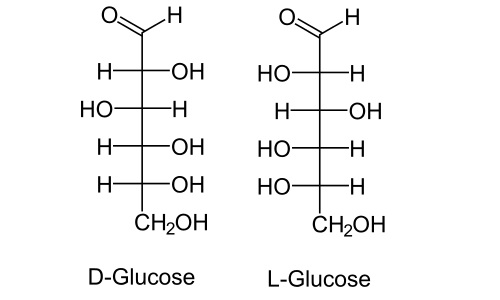
Хиральность – это крайне важное свойство для биологически активных соединений. В процессах жизнедеятельности участвуют только изомеры с определенным строением. И практически все значимые для организма вещества устроены так, что имеют как минимум один хиральный центр. Самый популярный пример – сахара́. Вот глюкоза. В ее цепочке шесть атомов углерода. Из них четыре атома имеют возле себя четыре различных заместителя. Значит, всего для глюкозы существует 16 возможных оптических изомеров. Все они подразделяются на две большие группы по конфигурации ближайшего к спиртовой группе асимметрического атома углерода: D-сахариды и L-сахариды. В обменных процессах в живом организме участвуют только D-сахариды.
Также довольно распространенный для стереоизомерии в биоорганической химии пример – аминокислоты. Все природные аминокислоты имеют аминогруппы возле ближайшего к карбоксильной группе атома углерода. Таким образом, в любой аминокислоте этот атом будет асимметрическим (различные заместители – карбоксильная группа, аминогруппа, водород и остальная часть цепочки; исключение – глицин с двумя атомами водорода).
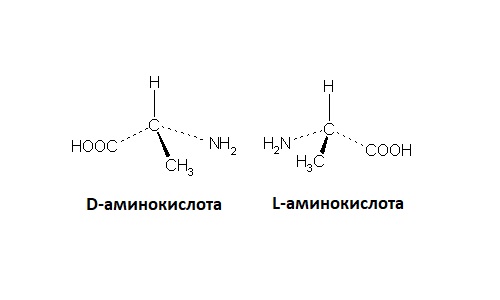
Соответственно, по конфигурации этого атома все аминокислоты также делят на D-ряд и L-ряд, только в природных процессах, в отличие от сахаров, преобладает L-ряд.



























