Алканы с химической точки зрения представляют собой углеводороды, то есть общая формула алканов включает в себя исключительно атомы углерода и водорода. Помимо того, что эти соединения не содержат никаких функциональных групп, они образуются только за счет одинарных связей. Такие углеводороды называются насыщенными.
Типы алканов
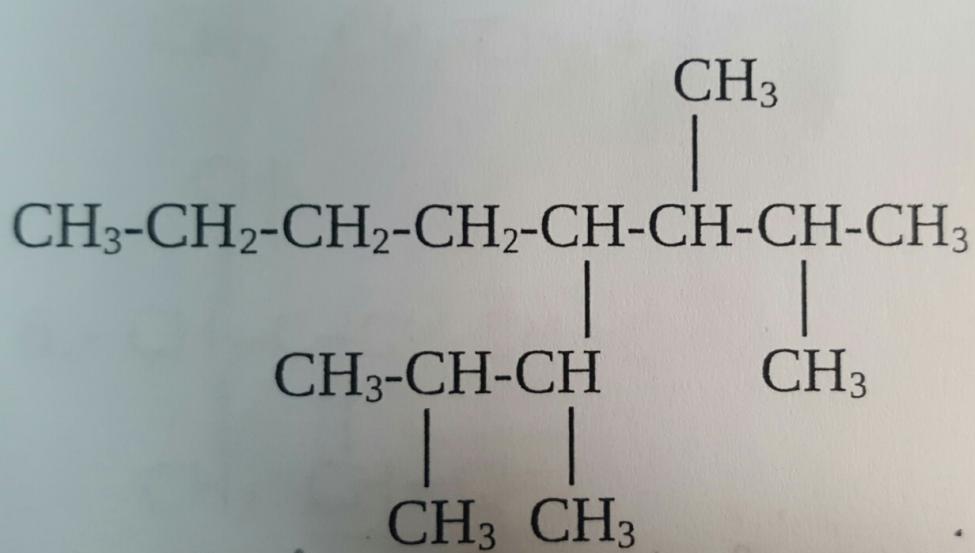
Все алканы можно выделить в две большие группы:
- Алифатические соединения. Их структура имеет вид линейной цепочки, общая формула алканов алифатического типа CnH2n+2, где n - количество атомов углерода в цепи.
- Циклоалканы. Эти соединения имеют циклическую структуру, что обуславливает существенное отличие их химических свойств от линейных соединений. В частности, структурная формула алканов этого типа обуславливает сходство их свойств с алкинами, то есть углеводородами с тройной связью между атомами углерода.
Электронная структура алифатических соединений
Эта группа алканов может иметь либо линейную, либо разветвленную углеводородную цепь. Их химическая активность является невысокой по сравнению с другими органическими соединениями, поскольку все связи внутри молекулы являются насыщенными.
Молекулярная формула алканов алифатического типа говорит о том, что их химическая связь имеет sp3-гибридизацию. Это означает, что все четыре ковалентные связи вокруг атома углерода по своим характеристикам (геометрическим и энергетическим) являются абсолютно равноправными. При таком типе гибридизации электронные оболочки уровней s и p атомов углерода имеют одинаковую форму вытянутой гантели.
Между атомами углерода связь в цепи является ковалентной, а между атомом углерода и водорода она частично поляризована, при этом электронная плотность оттягивается к углероду, как к элементу более электроотрицательному.
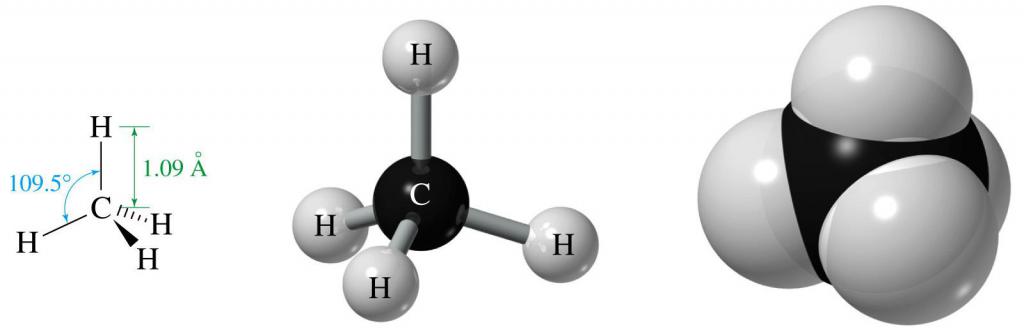
Из общей формулы алканов следует, что в их молекулах существуют только связи C-C и C-H. Первые образуются в результате перекрывания двух электронных гибридизованных орбиталей sp3 двух атомов углерода, а вторые образуются при перекрывании орбитали s водорода и орбитали sp3 углерода. Длина связи C-C равна 1,54 ангстрема, а связи C-H - 1,09 ангстрема.
Геометрия молекулы метана
Метан является самым простым алканом, который состоит всего из одного атома углерода и четырех атомов водорода.
Благодаря энергетической равноправности его трех 2p и одной 2s орбиталей, полученной в результате sp3-гибридизации, все орбитали в пространстве расположены под одинаковым углом друг к другу. Он равен 109,47°. В результате такой молекулярной структуры в пространстве образуется подобие треугольной равносторонней пирамиды.
Простые алканы
Самым простым алканом является метан, который состоит из одного атома углерода и четырех атомов водорода. Следующие в ряду алканов за метаном пропан, этан и бутан образованы тремя, двумя и четырьмя атомами углерода соответственно. Начиная с пяти атомов углерода в цепи, соединения получили название согласно номенклатуре ИЮПАК.
Таблица с формулами алканов и их названиями приведена ниже:
| Название | метан | этан | пропан | бутан | пентан | гексан | гептан | октан | нонан | декан |
| Формула | CH4 | C2H6 | C3H8 | C4H10 | C5H12 | C6H14 | C7H16 | C8H18 | C9H20 | C10H22 |
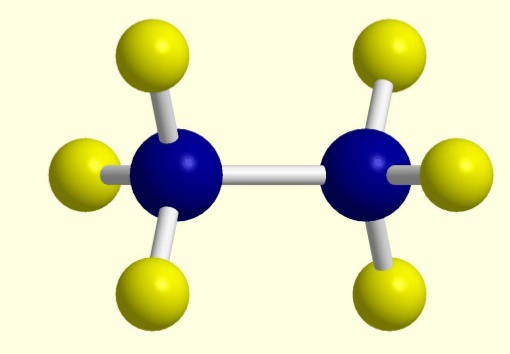
При потере одного водородного атома у молекулы алкана образуется активный радикал, окончание которого меняется с "ан" на "ил", например, этан C2H6 - этил C2H5. Структурная формула алкана этана приведена на фото.
Номенклатура органических соединений
Правила определения названий алканов и соединений на их основе установлены международной номенклатурой ИЮПАК. Для органических соединений действуют следующие правила:
- Название химического соединения базируется на названии его самой длинной цепи из атомов углерода.
- Нумерацию атомов углерода следует начинать с конца, ближе к которому начинается разветвление цепи.
- Если в соединении присутствуют две или более углеродные цепи одинаковой длины, то в качестве основной выбирается та, которая имеет меньше всего радикалов, и они имеют более простую структуру.
- Если в молекуле имеются две и более одинаковые группы радикалов, тогда в названии соединения используются соответствующие префиксы, которые удваивают, утраивают и так далее названия указанных радикалов. Например, вместо выражения "3-метил-5-метил" используется "3,5-диметил".
- Все радикалы записываются в алфавитном порядке в общее название соединения, при этом префиксы не берутся во внимание. Последний радикал пишется слитно с названием самой цепи.
- Числа, отражающие номера радикалов в цепи, отделяются от названий дефисом, а сами цифры записываются через запятую.
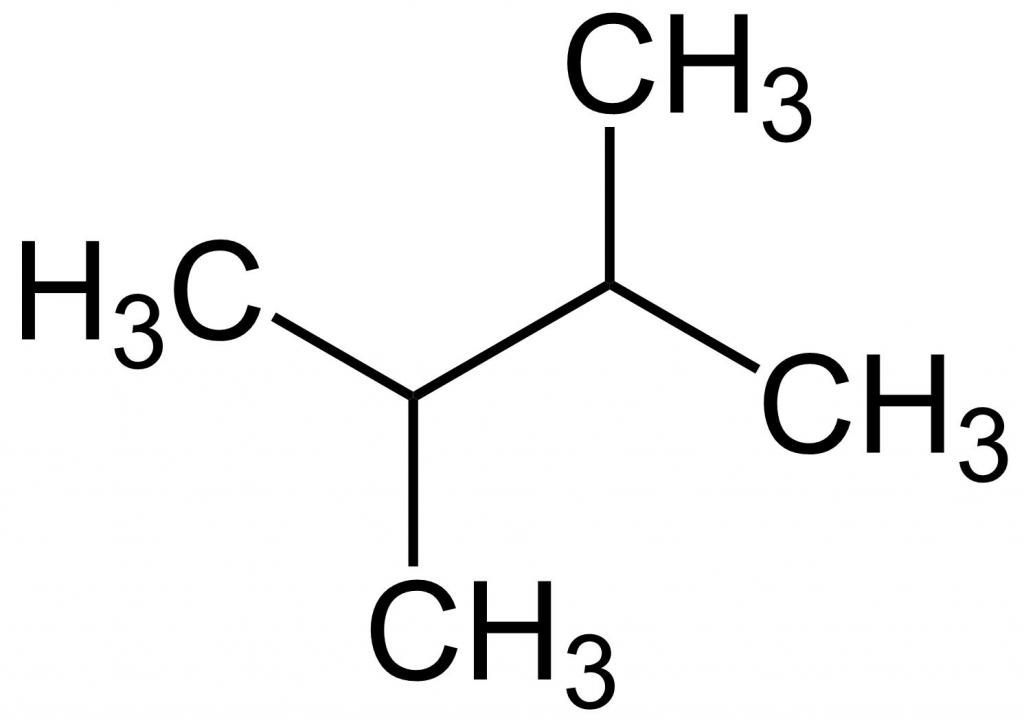
Соблюдение правил номенклатуры ИЮПАК позволяет легко определить молекулярную формулу алкана по названию вещества, например, 2,3-диметилбутан имеет следующий вид.
Физические свойства
Физические свойства алканов во многом зависят от длины углеродной цепи, образующей конкретное соединение. Основными свойствами являются следующие:
- Первые четыре представителя, согласно общей формуле алканов, при нормальных условиях находятся в газообразном состоянии, то есть это бутан, метан, пропан и этан. Что касается пентана и гексана, то они существуют уже в виде жидкостей, а начиная с семи атомов углерода, алканы представляют собой твердые вещества.
- При увеличении длины углеродной цепи увеличивается и плотность соединения, а также его температуры фазовых переходов первого рода, то есть температуры плавления и кипения.
- Поскольку полярность химической связи в формуле вещества алканов является незначительной, они не растворяются в полярных жидкостях, например, в воде.
- Соответственно их можно использовать в качестве хороших растворителей таких соединений, как неполярные жиры, масла и воски.
- В домашней газовой плите используется смесь алканов, богатая третьим членом химического ряда - пропаном.
- При кислородном горении алканов выделяется большое количество энергии в виде тепла, поэтому эти соединения используют в качестве горючего топлива.
Химические свойства
Ввиду наличия стабильных связей в молекулах алканов, их реакционная способность в сравнении с другими органическими соединениями является низкой.
С ионными и полярными химическими соединениями алканы практически не реагируют. Они ведут себя инертно в растворах кислот и оснований. Алканы вступают в реакцию только с кислородом и галогенами: в первом случае речь идет о процессах окисления, во втором - о процессах замещения. Некоторую химическую активность они проявляют и в реакциях с переходными металлами.
Во всех этих химических реакциях важную роль играют разветвления углеродной цепи алканов, то есть наличие в них радикальных групп. Чем их больше, тем сильнее изменяется идеальный угол между связями 109,47° в пространственной структуре молекулы, что приводит к созданию напряжений внутри нее и, как следствие, увеличивает химическую активность такого соединения.
Реакция простых алканов с кислородом происходит по следующей схеме: CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2.
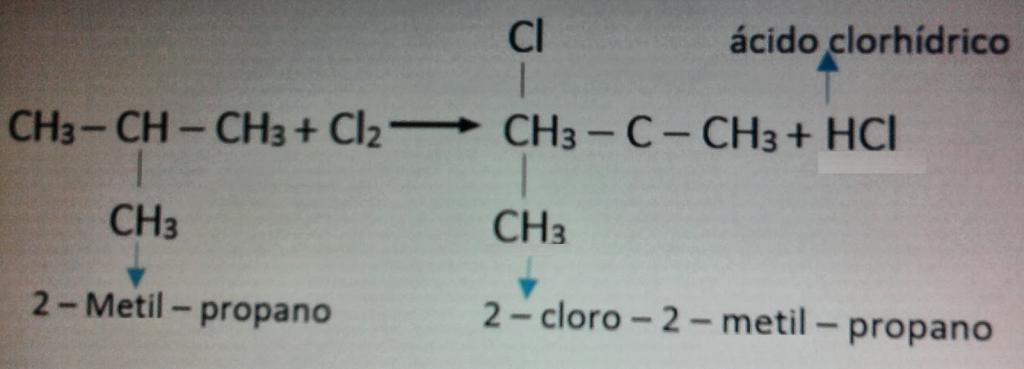
Пример реакции с хлором приведен на фото ниже.
Опасность алканов для природы и человека
При содержании метана в воздухе в интервале концентраций 1-8% образуется взрывная смесь. Опасность для человека заключается еще и в том, что этот газ не имеет цвета и запаха. Кроме того, метан обладает сильным парниковым эффектом. Остальные алканы, имеющие в своем составе несколько атомов углерода, также образуют взрывные смеси с воздухом.
Гептан, пентан и гексан представляют собой легко воспламеняющиеся жидкости и являются опасными как для окружающей среды, так и для здоровья человека, поскольку они токсичны.



























