Углекислый газ - невидимый, но очень важный газ, окружающий нас повсюду. Он присутствует в атмосфере, пище, напитках и даже в нашем организме. Углекислый газ играет ключевую роль в поддержании жизни на Земле.
История открытия углекислого газа
Впервые это вещество было обнаружено в XVII веке фламандским химиком Йоханом Баптистом ван Гельмонтом. Он заметил, что при сжигании древесного угля его масса уменьшается, потому что масса оставшейся золы меньше изначальной массы древесины. Гельмонт сделал вывод, что недостающая часть превратилась в невидимый газ, который он назвал "лесным духом".
Первое подробное исследование свойств этого газа провел в 1754 году шотландский врач Джозеф Блэк. Он обнаружил, что при взаимодействии карбоната кальция с кислотой выделяется газ, который назвал "неподвижным воздухом". Блэк выяснил, что этот газ тяжелее воздуха и не поддерживает горение. Также он показал, что углекислый газ содержится в дыхании млекопитающих.
А в 1772 году Джозеф Пристли создал первую газированную воду. Для этого он растворил диоксид углерода, полученный реакцией серной кислоты и известняка, в воде.
Физико-химические свойства
Диоксид углерода при нормальных условиях - бесцветный газ без запаха. Его плотность составляет 1,98 кг/м3, он в 1,5 раза тяжелее воздуха. Молекула СО2 линейная, расстояние между атомами 116,3 пм.
- Твердое состояние диоксида углерода называют "сухой лед". Он сублимируется при -78,5°C, минуя жидкую фазу.
- Жидкий СО2 получают при температуре выше 31,1°C и давлении более 5,2 МПа.
- Критическая температура составляет 31,1°C, критическое давление - 7,39 МПа.
По химическим свойствам углекислый газ относится к кислотным оксидам. Он взаимодействует со щелочами с образованием солей - карбонатов и гидрокарбонатов:
2NaOH + CO2 → Na2CO3 + H2O
Растворяясь в воде, диоксид углерода образует слабый раствор угольной кислоты. Равновесие этой реакции сильно смещено в сторону исходных веществ:
CO2 + H2O ↔ H2CO3
Углекислый газ не горит и не поддерживает горение. Но в его атмосфере могут гореть некоторые очень активные металлы, например щелочные или щелочноземельные:
2Mg + CO2 → 2MgO + C
Наличие в природе
Углекислый газ естественным образом содержится:
- В атмосфере Земли (около 0,04% по объему).
- В минеральных источниках.
- В продуктах жизнедеятельности животных и растений.
- В вулканических газах.
- В океане и других водоемах в растворенном виде.
- В составе горных пород (карбонаты).
Также диоксид углерода присутствует в атмосферах некоторых планет:
- Венеры (96,5% по объему)
- Марса (95% по объему)
На Земле углекислый газ активно участвует в круговороте веществ между атмосферой, гидросферой, литосферой и биосферой. Океаны и почвы являются основными резервуарами для его долговременного хранения.
Круговорот углерода
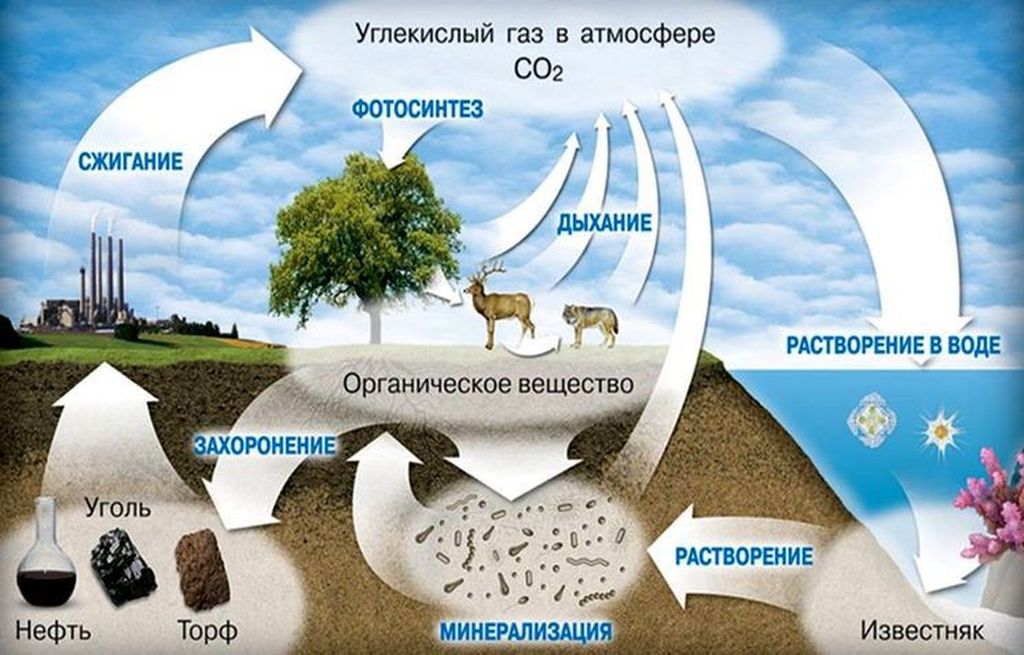
В биосфере происходит постоянный круговорот углерода между живыми организмами, атмосферой, гидросферой и литосферой. Диоксид углерода играет в нем одну из ключевых ролей.
Растения поглощают СО2 из воздуха, а животные получают углерод, поедая растения или других животных. После отмирания организмов происходит разложение с выделением углекислого газа.
Получение
В лабораторных условиях углекислый газ можно получить взаимодействием карбонатов или гидрокарбонатов с кислотами. Например, при действии соляной кислоты на мрамор (карбонат кальция) или соду (гидрокарбонат натрия) происходит реакция:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Для этого часто используют специальный химический прибор - аппарат Киппа. Он позволяет собирать и накапливать газообразные продукты реакции.
В промышленности углекислый газ получают в основном путем сжигания органических веществ, содержащих углерод:
C + O2 → CO2
Также применяется разложение природных карбонатов при высоких температурах с получением CO2.
Хранение и транспортировка
Для хранения и транспортировки углекислого газа чаще всего используют стальные баллоны под высоким давлением. При этом диоксид углерода находится в жидком состоянии, что гораздо выгоднее по объему по сравнению с газообразным.
В стандартный 40-литровый баллон заливают около 20 кг сжиженного СО2. При комнатной температуре в баллоне сохраняется жидкая фаза, а давление составляет примерно 60 атмосфер.
Рабочее давление для таких баллонов - 150 кгс/см2. Предел прочности по давлению должен быть минимум в 1,5 раза выше для обеспечения безопасности.
Углекислый газ: формула
Молекулярная формула диоксида углерода - CO2. Это означает, что его молекула состоит из:
- 1 атома углерода
- 2 атомов кислорода
Согласно химической номенклатуре, префикс "ди-" в названии указывает на наличие двух атомов кислорода в молекуле.
Применение
Благодаря своим уникальным свойствам, углекислый газ находит широкое применение в разных областях:
- Пищевая промышленность (производство газированных напитков)
- Медицина (криохирургия)
- Пожаротушение
- Химическая промышленность (сырье для получения других соединений)
- Оружейная промышленность (пневматическое оружие)
- Сельское хозяйство (теплицы, ускоренный рост растений)
Помимо этого, диоксид углерода также применяют в производстве удобрений, металлургии, электронной промышленности и многих других отраслях.
Биологическая роль
Углекислый газ играет важную биологическую роль в организмах людей и животных. Он является конечным продуктом обмена веществ и образуется в тканях в результате дыхательных процессов. Затем транспортируется кровью.
Транспорт кровью
Перенос СО2 осуществляется несколькими способами:
- Химическая связь с гемоглобином эритроцитов
- В виде гидрокарбонат-ионов плазмы крови
- В форме физически растворенных молекул
В венозной крови концентрация диоксида углерода выше, чем в артериальной. Это связано с поглощением СО2 тканями и выделением его в кровоток.
Регуляция дыхания
Углекислый газ стимулирует дыхательный центр мозга. Частота и глубина дыхания регулируются именно концентрацией СО2, а не кислорода в крови.
Поэтому при вдыхании газов без кислорода ощущения нехватки воздуха не возникает. Это опасно, так как может привести к потере сознания.
Воздействие на человека
Повышенное содержание углекислого газа в воздухе отрицательно сказывается на самочувствии и работоспособности человека:
- Головные боли, слабость, сонливость
- Учащение пульса, повышение артериального давления
- Тошнота, рвота при высоких концентрациях
- Нарушения дыхания вплоть до остановки
Допустимое содержание СО2 в воздухе жилых помещений не должно превышать 0,1% или 1000 ppm.
Экологические аспекты

Атмосферный углекислый газ участвует в формировании парникового эффекта. Его повышенная концентрация в атмосфере ведет к глобальному потеплению на Земле.
Основная причина роста содержания CO2 - сжигание ископаемого топлива и другая деятельность человека. Это вызывает обеспокоенность ученых и экологов.
Для снижения выбросов предлагаются разные решения - от сокращения промышленности до перехода на альтернативные источники энергии.

























