Биоинженерам из Университета Райса (Техас, США) удалось объединить вирус, который поражает моль, c магнитными наночастицами и создать потенциальную новую терапию для борьбы с наследственными генетическими заболеваниями, такими как мышечная дистрофия, серповидные эритроциты, кистозный фиброз, атрофия мышц спины и некоторые формы рака.
Революционный метод генной терапии
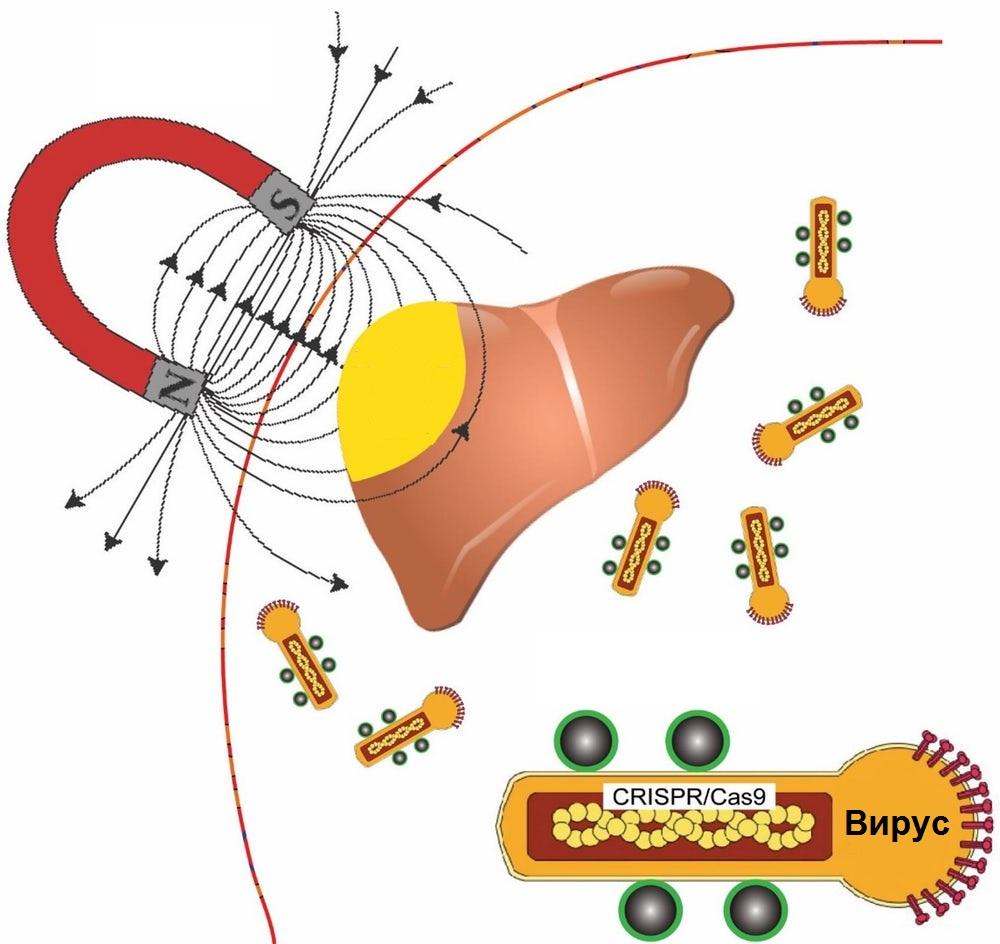
Исследователь Ган Бао и его коллеги объединили магнитные наночастицы с вирусным контейнером, взятым из определенного вида ночных бабочек, для доставки кода CRISPR/Cas9, который модифицирует генетический код в клетках определенной ткани или органа с пространственным контролем.
Поскольку магнитным полем манипулировать не сложно и, в отличие от света, оно легко проникает сквозь ткани, биоинженеры хотят использовать его для управления доставкой последовательности генетического кода в ткани-мишени. Находящийся в крови в неактивном состоянии вирус активируется только в тех местах, где присутствует поле.

Что такое CRISPR/Cas9?
Результаты исследования были опубликованы в журнале Nature Biomedical Engineering. В природе эндонуклеаза CRISPR/Cas9 укрепляет иммунную систему микроорганизмов, регистрируя чужеродную ДНК (например, бактериофагов и плазмид). Это дает бактериям способность распознавать и атаковать захватчиков при очередной встрече с ними, и ученые наперегонки пытаются адаптировать CRISPR/Cas9 для исправления мутаций, которые вызывают генетические заболевания, и манипулировать ДНК в лабораторных экспериментах.
Эндонуклеаза Cas9 способна остановить передаваемые по наследству болезни, если биоинженерам удастся доставить инструментарий для редактирования генома в нужные клетки внутри организма. Но препятствия на пути остаются, особенно в высокоэффективной трансдукции полезной нагрузки для обработки генов.
Почему важна адресная доставка редактора ДНК?
По словам Ган Бао, редактировать клетки в организме необходимо для лечения многих заболеваний. Но эффективная пространственно контролируемая доставка инструментов для изменения генома в целевую ткань в организме остается серьезной проблемой. Даже если ввести бакуловирусный вектор локально, он может попасть в другие ткани и органы, а это может представлять опасность.
Средство транспортировки, разработанное группой Бао, основано на вирусе, который заражает Autographa californica, также известную как калифорнийская люцерновая совка, обитающая в Северной Америке. Цилиндрический вектор бакуловируса (BV), несущий полезную нагрузку в виде фрагмента генетического кода, считается большим и достигает в диаметре до 60 нм и 200-300 нм в длину. Этого достаточно, чтобы транспортировать более 38 000 пар оснований ДНК, которых хватит, чтобы доставить в клетку-мишень несколько блоков редактирования гена.
Как возникла эта идея?
По словам ведущего биоинженера исследования Ган Бао, идея объединить вектор бакуловируса и магнитные наночастицы пришла к нему из дискуссий с доктором-исследователем Университета Райса Хайбао Чжу. Коллега и соавтор узнал об этом вирусе во время своего пребывания в Сингапуре. Но ничего не знал о магнитных наночастицах, пока не присоединился к лаборатории Бао. Команда исследователей уже имела опыт использования частиц оксида железа и приложенного магнитного поля для открытия стенок кровеносных сосудов с целью пропуска крупных молекул.
Биоинженеры признались, что они действительно не знали, будет ли это работать для редактирования генов, но решили, что попытка того стоит.
Как контролируется работа вектора бакуловируса?
Исследователи используют магнитные наночастицы для активации BV и транспортировки данных для редактирования генов только в те места, которые нужно. Для этого они применяют белок иммунной системы под названием C3, который обычно инактивирует бакуловирусы.
Если объединить BV с наночастицами оксида железа, то, применив магнитное поле, можно преодолеть эту дезактивацию. Красота этого решения заключается в том, что после доставки редактирование генов происходит только в тех тканях или частях тканей, в которых присутствует поле.
Магнит позволяет трансформировать вектор бакуловируса, начав процесс трансдукции полезной нагрузки, в результате которой редактирующий ген код попадает в клетку-мишень. Полезная нагрузка – это тоже ДНК, которая кодирует как необходимый ген, так и систему CRISPR/Cas9.

На какой стадии находится разработка?
В проводившихся тестах бакуловирусный вектор загружался зелеными флуоресцентными белками или люциферазой светлячков. Клетки с белком ярко светились под микроскопом, и эксперименты показали, что наномагниты очень эффективны при адресной доставке BV-грузов как в клеточные культуры, так и в ткани лабораторных животных.
Ган Бао отметил, что наряду с другими его лаборатория работает над поставкой CRISPR/Cas9 с адено-ассоциированными вирусами (AAV), но способность BV к транспортировке терапевтических грузов примерно в восемь раз больше. Тем не менее необходимо еще больше повысить эффективность трансдукции BV в клетки-мишени.





















