Кислородсодержащие соединения: примеры, свойства, формулы
Один из наиболее распространенных химических элементов, входящий в подавляющее большинство химических веществ – это кислород. Оксиды, кислоты, основания, спирты, фенолы и другие кислородсодержащие соединения изучаются в курсе неорганической и органической химии. В нашей статье мы изучим свойства, а также приведем примеры их применения в промышленности, сельском хозяйстве и медицине.
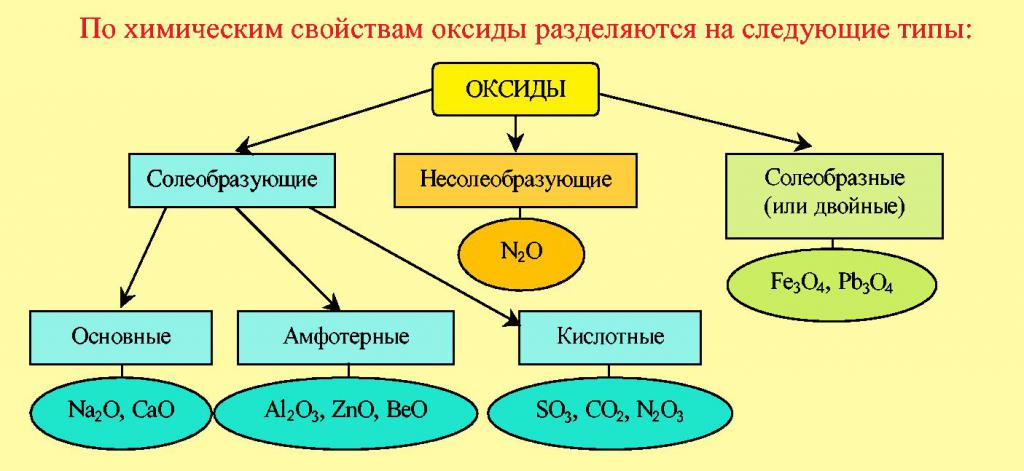
Оксиды
Наиболее простыми по строению являются бинарные соединения металлов и неметаллов с кислородом. Классификация оксидов включает следующие группы: кислотные, основные, амфотерные и безразличные. Главный критерий деления всех этих веществ заключается в том, какой элемент соединяется с кислородом. Если это металл, то они относятся к основным. Например: CuO, MgO, Na2O – окиси меди, магния, натрия. Их основное химическое свойство – это реакция с кислотами. Так, оксид меди реагирует с хлоридной кислотой:
CuO + 2HCl -> CuCl2 + H2O + 63, 3 кДж.
Присутствие атомов неметаллических элементов в молекулах бинарных соединений свидетельствует об их принадлежности к кислотным оксидам, например, окись водорода H2O, углекислый газ CO2, пятиокись фосфора P2O5. Способность таких веществ реагировать со щелочами – главная их химическая характеристика.
В результате реакции могут образовываться соли двух видов: кислые или средние. Это будет зависеть от того, сколько моль щелочи вступает в реакцию:
- CO2 + KOH => KHCO3;
- CO2+ 2KOH => K2CO3 + H2O.
Еще одну группу кислородсодержащих соединений, в которые входят такие химические элементы, как цинк или алюминий, относят к амфотерным оксидам. В их свойствах прослеживается тенденция к химическому взаимодействию как с кислотами, так и со щелочами. Продуктами взаимодействия кислотных оксидов с водой являются кислоты. Например, в реакции серного ангидрида и воды образуется сульфатная кислота. Кислоты – это один из наиболее важных классов кислородсодержащих соединений.
Кислоты и их свойства
Соединения, состоящие из водородных атомов, связанных со сложными ионами кислотных остатков – это кислоты. Условно их можно разделить на неорганические, например, карбонатную кислоту, сульфатную, нитратную, и органические соединения. К последним принадлежат уксусная кислота, муравьиная, олеиновая кислоты. Обе группы веществ имеют схожие свойства. Так, они вступают в реакцию нейтрализации с основаниями, реагируют с солями и основными оксидами. Практически все кислородсодержащие кислоты в водных растворах диссоциируют на ионы, являясь проводниками второго рода. Определить кислый характер их среды, обусловленной избыточным присутствием водородных ионов, можно с помощью индикаторов. Например, фиолетовый лакмус при добавлении его в раствор кислоты приобретает красную окраску. Типичным представителем органических соединений является уксусная кислота, содержащая карбоксильную группу. В нее входит атом водорода, который и обуславливает кислотные свойства вещества. Это бесцветная жидкость со специфическим резким запахом, кристаллизующаяся при температуре ниже 17 °С. CH3COOH, как и другие кислородсодержащие кислоты, прекрасно растворяется в воде в любых пропорциях. Ее 3 – 5 % раствор известен в быту под названием уксуса, который используют в кулинарии как приправу. Вещество нашло свое применение также в производстве ацетатного шелка, красителей, пластических масс и некоторых лекарственных средств.
Органические соединения, содержащие кислород
В химии можно выделить большую группу веществ, содержащих, кроме углерода и водорода, еще и кислородные частицы. Это карбоновые кислоты, эфиры, альдегиды, спирты и фенолы. Все их химические свойства определяются присутствием в молекулах особых комплексов – функциональных групп. Например, общая химическая формула спирта, содержащего только предельные связи между атомами – ROH, где R – углеводородный радикал. Эти соединения принято рассматривать как производные алканов, у которых один водородный атом замещен гидроксогруппой.
Физические и химические свойства спиртов
Агрегатное состояние спиртов – это жидкости или твердые соединения. Среди спиртов нет газообразных веществ, что можно объяснить образованием ассоциатов – групп, состоящих из нескольких молекул, соединенных слабыми водородными связями. Этим фактом определяется и хорошая растворимость низших спиртов в воде. Однако в водных растворах кислородсодержащие органические вещества – спирты, не диссоциируют на ионы, не изменяют цвет индикаторов, то есть имеют нейтральную реакцию. Атом водорода функциональной группы слабо связан с другими частицами, поэтому в химических взаимодействиях способен покидать пределы молекулы. По месту же свободной валентности происходит его замещение на другие атомы, например, в реакциях с активными металлами или со щелочами – на атомы металла. В присутствии катализаторов, таких, как платиновая сетка или медь, спирты окисляются энергичными окислителями – бихроматом или перманганатом калия, до альдегидов.
Реакция этерификации
Одно из важнейших химических свойств кислородсодержащих органических веществ: спиртов и кислот – это реакция, приводящая к получению сложных эфиров. Она имеет большое практическое значение и используется в промышленности для добывания эстеров, применяемых в качестве растворителей, в пищевой промышленности (в виде фруктовых эссенций). В медицине некоторые из эфиров применяют в качестве спазмолитиков, например, этилнитрит расширяет периферические кровеносные сосуды, а изоамилнитрит является протектором спазмов коронарных артерий. Уравнение реакции этерификации имеет следующий вид:
CH3COOH+C2H5OH<--(H2SO4)-->CH3COOC2H5+H2O
В ней CH3COOH – это уксусная кислота, а C2H5OH – химическая формула спирта этанола.
Альдегиды
Если соединение содержит функциональную группу –COH, то оно относится к альдегидам. Их представляют как продукты дальнейшего окисления спиртов, например, такими окислителями, как оксид меди.
Присутствие карбонильного комплекса в молекулах муравьиного или уксусного альдегида обуславливают их способность полимеризоваться и присоединять атомы других химических элементов. Качественными реакциями, с помощью которых можно доказать наличие карбонильной группы и принадлежность вещества к альдегидам, являются реакция серебряного зеркала и взаимодействие с гидроокисью меди при нагревании:
Наибольшее применение получил ацетальдегид, используемый в промышленности для получения уксусной кислоты – много тоннажного продукта органического синтеза.
Свойства кислородсодержащих органических соединений – карбоновых кислот
Наличие карбоксильной группы – одной или нескольких – это отличительная черта карбоновых кислот. Благодаря строению функциональной группы, в растворах кислот могут образовываться димеры. Они связаны между собой водородными связями. Соединения диссоциируют на катионы водорода и анионы кислотного остатка и являются слабыми электролитами. Исключением служит первый представитель ряда предельных одноосновных кислот – муравьиная, или метановая, являющаяся проводником второго рода средней силы. Присутствие в молекулах только простых сигма- связей говорит о предельности, если же вещества имеют в своем составе двойные пи-связи – это непредельные вещества. К первой группе относятся такие кислоты, как метановая, уксусная, масляная. Вторая представлена соединениями, входящими в состав жидких жиров – масел, например, олеиновой кислотой. Химические свойства кислородсодержащих соединений: органических и неорганических кислот во многом похожи. Так, они могут взаимодействовать с активными металлами, их оксидами, со щелочами, а также со спиртами. Например, уксусная кислота реагирует с натрием, оксидом и едким натром с образованием соли – ацетата натрия:
NaOH + CH3COOH→NaCH3COO + H2O
Особое место занимают соединения высших карбоновых кислородсодержащих кислот: стеариновой и пальмитиновой, с трехатомным предельным спиртом – глицерином. Они относятся к сложным эфирам и называются жирами. Эти же кислоты входят в состав солей натрия и калия в качестве кислотного остатка, образуя мыла.
Жиры и мыла
Важные органические соединения, широко распространенные в живой природе и играющие ведущую роль в качестве наиболее энергоемкого вещества – это жиры. Они представляют собой не индивидуальное соединение, а смесь разнородных глицеридов. Это соединения предельного многоатомного спирта – глицерина, который, как и метанол и фенол, содержит гидроксильные функциональные группы. Жиры можно подвергнуть гидролизу – нагреванию с водой в присутствии катализаторов: щелочей, кислот, оксидов цинка, магния. Продуктами реакции будут глицерин и различные карбоновые кислоты, в дальнейшем используемые для производства мыла. Чтобы в этом процессе не использовать дорогостоящие природные пищевые жиры, необходимые карбоновые кислоты получают, окисляя парафин.
Фенолы
Заканчивая рассматривать классы кислородсодержащих соединений, остановимся на фенолах. Они представлены радикалом фенилом -C6H5, соединенным с одной или несколькими функциональными гидроксильными группами. Простейший представитель этого класса – карболовая кислота, или фенол. Как очень слабая кислота, он может взаимодействовать со щелочами и активными металлами – натрием, калием. Вещество с ярко выраженными бактерицидными свойствами - фенол применяется в медицине, в также при производстве красителей и фенолформальдегидных смол.
В нашей статье мы изучили основные классы кислородсодержащих соединений, а также рассмотрели их химические свойства.
