P2O5 и H2O: особенности взаимодействия и практическое использование
Пентаоксид фосфора (P2O5) активно взаимодействует с водой с образованием фосфорной кислоты. Эта реакция имеет важное практическое значение, поэтому давайте подробно разберем ее особенности и возможности использования.
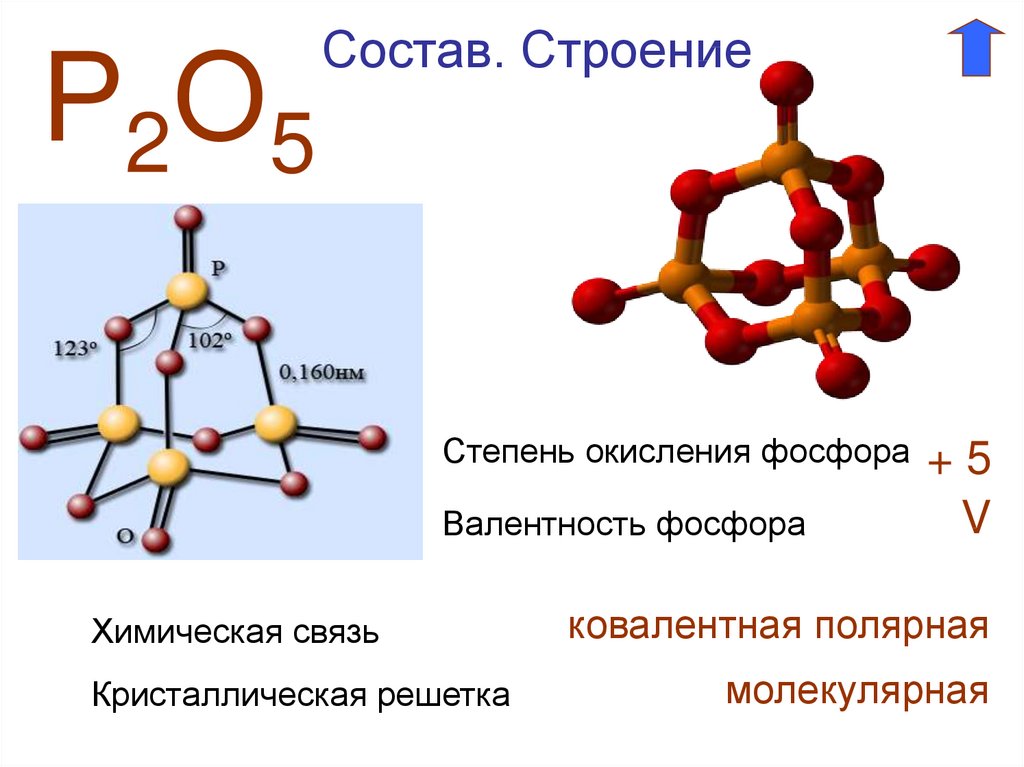
Химические свойства и получение P2O5
Пентаоксид фосфора представляет собой белый порошок, состоящий из молекул P4O10. Он гигроскопичен и активно поглощает влагу из воздуха и других веществ:
Оксид фосфора(V) — очень гигроскопичное вещество, которое используется для осушения газов.
Это свойство P2O5 объясняется его химической активностью. Рассмотрим подробнее различные реакции пентаоксида фосфора.

Химические реакции P2O5 с неорганическими веществами
Пентаоксид фосфора проявляет свойства типичного кислотного оксида. Он энергично взаимодействует с водой, щелочами, основными оксидами:
- P2O5 + H2O = 2H3PO4 (ортофосфорная кислота)
- P2O5 + 2NaOH = Na2HPO4 + H2O
- P2O5 + BaO = Ba3(PO4)2 (при нагревании)
Также пентаоксид фосфора окисляет некоторые неорганические вещества, например:
- 2PH3 + 5P2O5 = 2H3PO4 + 5P2O4
- P2O5 + 6HI = 2H3PO4 + 6I2↑
Реакции P2O5 с органическими веществами
С органическими веществами P2O5 также легко вступает в реакцию. Особенно активно протекают процессы дегидратации и декарбоксилирования:
- 2RCOOH + P2O5 = 2RC=O + H3PO4 (дегидратация карбоновых кислот)
- 2RCONH2 + 3P2O5 = 2RC≡N + 2H3PO4 (декарбоксилирование амидов)
Кроме того, P2O5 взаимодействует с многими другими классами органических соединений, например спиртами, фенолами и простыми эфирами.
Получение P2O5 в лаборатории и промышленности
В лабораторных условиях пентаоксид фосфора можно получить прокаливанием фосфорной кислоты или ее солей:
- 2H3PO4 = P2O5 + 3H2O↑
- Ca3(PO4)2 = 3CaO + P2O5↑ (при температуре >1300°C)
Однако в промышленных масштабах P2O5 производят окислением белого фосфора кислородом воздуха при температуре около 300°C. Процесс проводят в специальных печах непрерывного действия. Получаемый пентаоксид фосфора очищают перегонкой.
Технический продукт представляет собой белый порошок, состоящий из смеси разных кристаллических модификаций P2O5.
Взаимодействие P2O5 с H2O: механизм и кинетика
Рассмотрим более детально процесс взаимодействия пентаоксида фосфора с водой, который лежит в основе получения фосфорной кислоты.
Стадии взаимодействия P2O5 с H2O
При смешивании P2O5 с водой происходит бурная реакция с выделением большого количества тепла. Процесс протекает в несколько стадий:
- Гидратация P2O5 с образованием метафосфорной кислоты:
- Переход метафосфорной кислоты в ортофосфорную:
- Дальнейшая гидратация орто-кислоты:
Таким образом, конечным продуктом является ортофосфорная кислота H3PO4.
Влияние условий на скорость реакции
Скорость взаимодействия P2O5 и H2O зависит от ряда факторов:
- Температура - повышение температуры ускоряет реакцию
- Соотношение реагентов - избыток воды увеличивает скорость
- Перемешивание - интенсивное перемешивание ускоряет контакт реагентов
Учет этих факторов важен при оптимизации процесса получения H3PO4.
Различные типы фосфорных кислот в результате гидратации P2O5
В зависимости от условий проведения процесса гидратации, помимо ортофосфорной кислоты могут образовываться метафосфорная и пирофосфорная кислоты:
| Тип кислоты | Формула |
| Метафосфорная | (HPO3)n |
| Пирофосфорная | H4P2O7 |
| Ортофосфорная | H3PO4 |
При быстром взаимодействии и недостатке воды образуется преимущественно метафосфорная кислота, которая затем постепенно переходит в ортофосфорную. Пирофосфорная кислота в основном образуется как промежуточный продукт.