Изотоп водорода: секреты легчайшего элемента
Изотопы водорода - уникальные формы самого распространенного элемента во Вселенной. Эта статья раскроет малоизвестные факты об изотопах легчайшего газа, который определяет судьбы звезд и планет. Узнайте, как изотопы водорода влияют на нашу жизнь сегодня.
История открытия водорода
Водород был впервые выделен и описан в XVI веке алхимиком Парацельсом. Он получил "горючий воздух" взаимодействием железных опилок и серной кислоты. Однако Парацельс не понимал истинной природы этого газа.
В 1766 году английский химик Генри Кавендиш впервые идентифицировал водород как отдельный химический элемент. Он назвал его "горючим воздухом" и предположил, что это гипотетическое вещество "флогистон".
Кавендиш писал: "Я называю этот газ горючим воздухом. Он намного легче обычного воздуха и воспламеняется при поднесении огня".
В 1783 году французский химик Антуан Лавуазье доказал, что при сгорании водорода образуется вода. Он дал элементу название от греческих слов "образующий воду".
Важнейшие вехи в истории понимания природы водорода:
- 16 век - Парацельс получает водород взаимодействием кислот и металлов
- 1766 год - Кавендиш открывает "горючий воздух"
- 1783 год - Лавуазье доказывает, что это элемент водород
Физические свойства водорода
Водород - самый легкий газ, в 14 раз легче воздуха. При нормальных условиях это бесцветный двухатомный газ H2 без запаха.
Температура кипения водорода составляет -252,76°C. В узком интервале температур от -259 до -253°C водород находится в жидком состоянии. Плотность жидкого водорода при -253°C всего 0,07 г/см3.
Твердый водород получают при температуре -259°C. Это снегообразная легкая масса, плотность 0,08 г/см3.
Существование металлического водорода при экстремально высоком давлении пока не подтверждено экспериментально. Это остается одной из фундаментальных проблем физики.
Химические свойства и реакции
Химические связи в молекуле водорода очень прочные. Для вступления H2 в реакцию требуется большая энергия.
Водород взаимодействует с активными металлами, например с кальцием:
Ca + H2 -> CaH2
При горении водорода образуется вода:
2H2 + O2 -> 2H2O
Водород применяют для восстановления органических соединений в присутствии катализаторов. Это важный процесс в органическом синтезе.
Основные реакции водорода:
- Горение
- Восстановление металлов из оксидов
- Образование кислот с галогенами
- Каталитическое гидрирование органических соединений
Таким образом, водород проявляет как окислительные, так и восстановительные свойства в зависимости от условий.
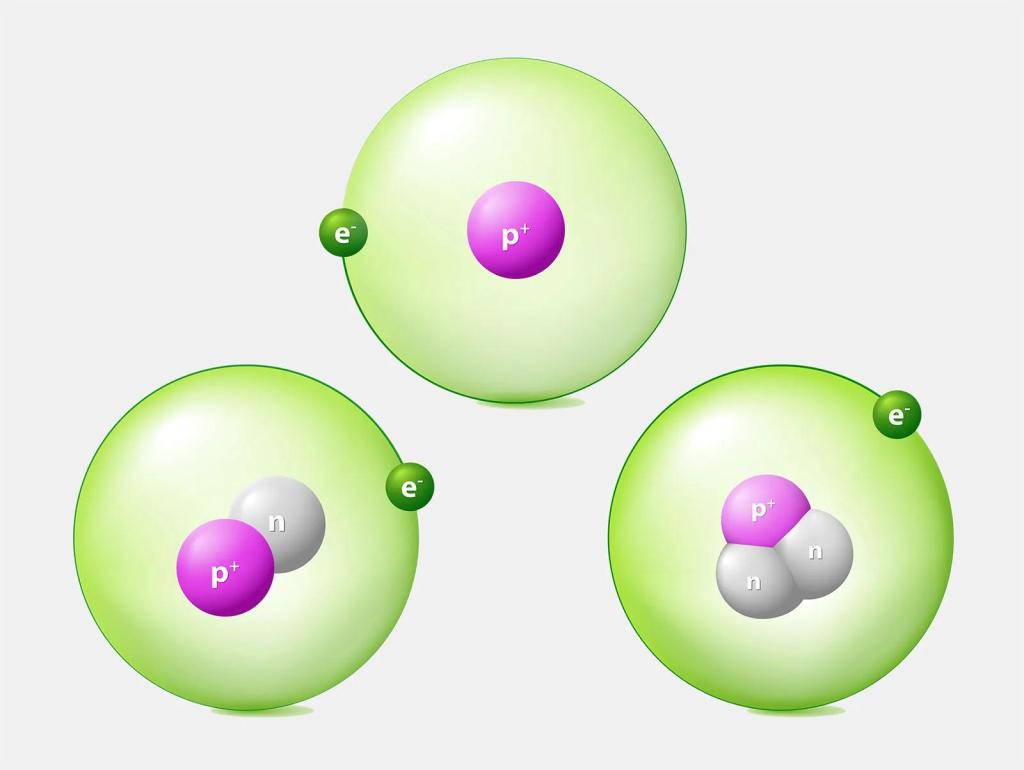
Изотопы водорода
Существует несколько стабильных и нестабильных изотопов водорода, отличающихся количеством нейтронов в ядре.
Наиболее распространен протий 1H, составляющий 99,98% природного водорода. Его ядро состоит из одного протона.
Дейтерий 2H содержит в ядре один протон и один нейтрон. Его доля в природном водороде около 0,02%.
Тритий 3H - радиоактивный изотоп с периодом полураспада 12 лет. В ядре трития один протон и два нейтрона.
Редкие радиоактивные изотопы водорода
Кроме основных изотопов, искусственно получены нестабильные изотопы водорода с массовыми числами от 4 до 7 и периодами полураспада порядка 10-23 секунд.
Изучение свойств этих редких изотопов водорода представляет фундаментальный интерес для ядерной физики.
Получение "тяжелой воды"
"Тяжелая вода" - это вода, в состав которой входит дейтерий. Ее можно получить обогащением обычной воды электролизом.
При электролизе дейтерий концентрируется у катода, так как перенапряжение выделения D2 меньше, чем H2. Это позволяет накапливать дейтерий и выделять его из "тяжелой воды".
Применение изотопов водорода
Различные изотопы водорода находят широкое применение в науке и технике.
Например, дейтерий используется в ЯМР-спектроскопии для "мечения" органических молекул. Тритий применяют в ядерной энергетике.
Водород в космосе
Водород - самый распространенный элемент во Вселенной. Он составляет основу звезд и межзвездного газа.
Водород присутствует в молекулярных облаках, туманностях и плазме звезд в виде атомов, молекул, ионов.
Производство водорода
В промышленности водород получают различными способами:
- Паровая конверсия метана
- Электролиз воды
- Реакция металлов с водой или кислотами
Наиболее распространен метод паровой конверсии природного газа. Примерно 4% мирового водорода производится электролизом.
Очистка водорода
Технический водород содержит примеси инертных газов, CO, CO2, H2O, которые удаляют с помощью низкотемпературной ректификации, адсорбции, мембранного разделения.
Для нужд ЯМР-спектроскопии требуется высокочистый водород с содержанием примесей на уровне ppm.
Хранение водорода
Водород хранят в газообразном или жидком виде в стальных баллонах высокого давления или криогенных резервуарах.
Перспективно создание твердых гидридов металлов для компактного и безопасного хранения водорода.
Транспортировка водорода
На небольшие расстояния водород перевозят в баллонах или на специальных автомобилях.
Для крупнотоннажных поставок применяют трубопроводный транспорт и перевозку охлажденного сжиженного газа морем.
Применение водорода
Основные области использования:
- Производство аммиака и метанола
- Гидрирование в оргсинтезе
- Гидрокрекинг в нефтепереработке
- Топливные элементы
- Ракетное топливо
Перспективы водородной энергетики
В будущем водород может стать основой низкоуглеродной энергетики, заменив ископаемые углеводороды.
Для этого необходимо решить ряд технических и экономических проблем:
- Снизить стоимость производства водорода
- Повысить эффективность топливных элементов
- Создать инфраструктуру для транспортировки и хранения
- Повысить безопасность использования водорода
Водород в транспорте
Водородные топливные элементы могут найти применение на транспорте для снижения вредных выбросов.
Уже разработаны опытные образцы автомобилей, поездов, кораблей на топливных элементах.
Для их массового распространения потребуется развитие сети водородных заправочных станций.
Экологические аспекты
Использование водорода вместо углеводородного топлива позволит снизить выбросы парниковых газов, так как продуктом реакции является вода.
Однако существуют опасения утечек водорода, которые могут привести к взрывам и пожарам.
Экономические аспекты
Массовый переход на водородную энергетику потребует значительных инвестиций в производство, инфраструктуру и транспорт.
Необходимы меры господдержки со стороны правительств для стимулирования этого перехода.
Безопасное использование водорода
Для безопасного применения водорода в быту и промышленности требуется:
- Соблюдение правил хранения и транспортировки
- Контроль концентрации в замкнутых помещениях
- Применение оборудования во взрывобезопасном исполнении
- Пожарная безопасность и аварийное реагирование
Биологическая роль водорода
Водород играет важную биологическую роль, входя в состав всех живых организмов.
По числу атомов на долю водорода приходится 63% от массы клетки.
Водород входит в состав воды, аминокислот, жиров, углеводов и других органических молекул живых организмов.
Водород в эволюции жизни
Существует гипотеза, что простейшие формы жизни могли возникнуть в водородсодержащей атмосфере Земли.
Водород мог служить источником энергии для абиогенного синтеза органических молекул.
Медицинское применение водорода
Изучается терапевтический эффект молекулярного водорода при различных заболеваниях.
Предполагается, что H2 действует как антиоксидант, уменьшая воспалительные процессы.
Проводятся клинические испытания ингаляции водорода при сердечно-сосудистых и неврологических заболеваниях.
Водород в питании
Некоторые продукты и напитки, в том числе питьевая вода, могут содержать растворенный водород.
Считается, что это полезно для здоровья, однако необходимы дополнительные научные доказательства.
Водородные сенсоры
Для контроля содержания водорода разрабатываются высокочувствительные сенсоры на основе наноматериалов и металлоорганических красителей.
Такие датчики могут найти применение для мониторинга утечек и обеспечения взрывобезопасности.