Мы постоянно сталкиваемся с различными химическими взаимодействиями. Сгорание природного газа, ржавление железа, скисание молока - далеко не все процессы, которые подробно изучаются в школьном курсе химии.
Для протекания одних реакций требуются доли секунд, а для некоторых взаимодействий нужны дни и недели.
Попробуем выявить зависимость скорости реакции от температуры, концентрации, иных факторов. В новом образовательном стандарте на данный вопрос отводится минимальное количество учебного времени. В тестах единого государственного экзамена есть задания на зависимость скорости реакции от температуры, концентрации и даже предлагаются расчетные задачи. Многие старшеклассники испытывают определенные сложности с поиском ответов на эти вопросы, поэтому подробно проанализируем данную тему.

Актуальность рассматриваемого вопроса
Информация о скорости реакции имеет важное практическое и научное значение. К примеру, в конкретном производстве веществ и продуктов от данной величины напрямую зависит производительность аппаратуры, стоимость товаров.
Классификация протекающих реакций
Существует прямая зависимость между агрегатным состоянием исходных компонентов и продуктов, образующихся в ходе химического процесса: гетерогенные взаимодействия.
Под системой принято подразумевать в химии вещество либо их совокупность.
Гомогенной считают такую систему, которая состоит из одной фазы (одинакового агрегатного состояния). В качестве ее примера можно упомянуть смесь газов, несколько различных жидкостей.
Гетерогенной является система, в которой реагирующие вещества находятся в виде газов и жидкостей, твердых тел и газов.
Существует не только зависимость скорости реакции от температуры, но и от того, в какой фазе используются компоненты, вступающие в анализируемое взаимодействие.
Для однородного состава характерно протекание процесса по всему объему, что существенно повышает его качество.
Если исходные вещества находятся в разных фазовых состояниях, в таком случае максимальное взаимодействие наблюдается на границе раздела фаз. К примеру, при растворении активного металла в кислоте, образование продукта (соли) наблюдается только на поверхности их соприкосновения.

Математическая зависимость между скоростью процесса и различными факторами
Как выглядит уравнение зависимости скорости химической реакции от температуры? Для гомогенного процесса скорость определяется количеством вещества, которое вступает во взаимодействие либо образуется в ходе реакции в объеме системы за единицу времени.
Для гетерогенного процесса скорость определяется через количество вещества, реагирующего либо получаемого в процессе на единице площади за минимальный промежуток времени.
Факторы, влияющие на скорость химической реакции
Природа реагирующих веществ – одна из причин разной скорости протекания процессов. Например, щелочные металлы при комнатной температуре образуют с водой щелочи, причем процесс сопровождается интенсивным выделением газообразного водорода. Благородные металлы (золото, платина, серебро) не способны к подобным процессам ни при комнатной температуре, ни при нагревании.
Природа реагирующих веществ – тот фактор, который учитывают в химической промышленности, чтобы повысить рентабельность производства.
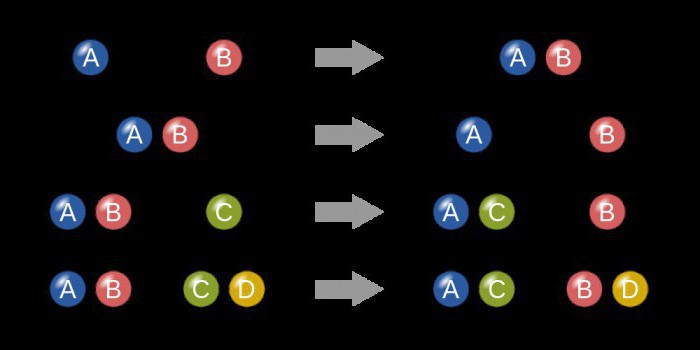
Выявлена зависимость между концентрацией реагентов и быстротой протекания химической реакции. Чем она будет выше, тем больше частиц будет сталкиваться, следовательно, процесс будет протекать быстрее.
Закон действующих масс в математическом виде описывает прямо пропорциональную зависимость между концентрацией исходных веществ и быстротой протекания процесса.
Он был сформулирован в середине девятнадцатого века русским химиком Н. Н. Бекетовым. Для каждого процесса определяется константа реакции, которая не связана ни с температурой, ни с концентрацией, ни с природой реагирующих веществ.
Для того чтобы ускорить реакцию, в которой участвует твердое вещество, нужно измельчить его до порошкообразного состояния.
При этом происходит возрастание площади поверхности, что позитивно сказывается на быстроте протекания процесса. Для дизельного топлива применяют специальную систему впрыска, благодаря чему при соприкосновении ее с воздухом скорость процесса сгорания смеси углеводородов существенно возрастает.
Нагревание
Зависимость скорости химической реакции от температуры объясняется молекулярно-кинетической теорией. Она позволяет провести расчет количества соударений между молекулами реагентов при определенных условиях. Если вооружиться подобной информацией, то при обычных условиях все процессы должны протекать мгновенно.
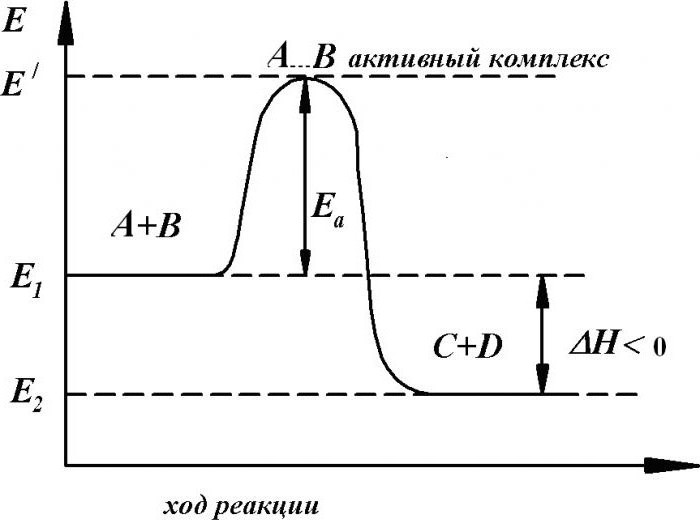
Но если рассмотреть конкретный пример зависимости скорости реакции от температуры, оказывается, что для взаимодействия необходимо сначала разорвать химические связи между атомами, чтобы из них образовались новые вещества. Это требует существенных затрат энергии. Какова зависимость скорости реакции от температуры? Энергия активации определяет возможность разрыва молекул, именно она характеризует реальность процессов. Ее единицами измерения является кДж/моль.
При недостаточном показателе энергии столкновение будет малоэффективным, поэтому оно не сопровождается образованием новой молекулы.
Графическое представление
Зависимость скорости химической реакции от температуры можно представить графически. При нагревании число столкновений между частицами возрастает, что способствует ускорению взаимодействия.
Как выглядит график зависимости скорости реакции от температуры? По горизонтали откладывается энергия молекул, а по вертикали указывается число частиц, имеющих высокий энергетический запас. Графиком является кривая, по которой можно судить о скорости протекания конкретного взаимодействия.
Чем больше будет отличие энергии от среднего показателя, тем дальше располагается от максимума точка кривой, и меньший процент молекул имеет такой запас энергии.
Важные аспекты
Можно ли записать уравнение зависимости константы скорости реакции от температуры? Ее повышение отражается на увеличении скорости процесса. Такая зависимость характеризуется определенной величиной, называемой температурным коэффициентом скорости процесса.
Для любого взаимодействия выявлена зависимость константы скорости реакции от температуры. В случае ее повышения на 10 градусов происходит увеличение скорости процесса в 2-4 раза.
Зависимость скорости гомогенных реакций от температуры можно представить в математическом виде.
Для большинства взаимодействий при комнатной температуре коэффициент находится в диапазоне от 2 до 4. К примеру, при значении температурного коэффициента 2,9 рост температуры на 100 градусов ускоряет процесс почти в 50000 раз.
Зависимость скорости реакции от температуры легко можно объяснить разной величиной энергии активации. Минимальную величину она имеет при проведении ионных процессов, которые определяются только взаимодействием катионов и анионов. Многочисленные эксперименты свидетельствуют о мгновенном протекании подобных реакций.
При высоком значении энергии активации лишь незначительное количество столкновений между частицами будет приводить к осуществлению взаимодействия. При среднем значении энергии активации, реагенты будут взаимодействовать со средней скоростью.
Задания на зависимость скорости реакции от концентрации и температуры рассматриваются только на старшей ступени обучения, часто вызывают у ребят серьезные затруднения.
Измерение быстроты протекания процесса
Те процессы, которые нуждаются в существенной энергии активации, предполагают первоначальный разрыв либо ослабление связей между атомами в исходных веществах. При этом происходит их переход в некое промежуточное состояние, именуемое активированным комплексом. Он является неустойчивым состоянием, довольно быстро распадается на продукты реакции, процесс сопровождается выделением дополнительной энергии.
В простейшем варианте активированный комплекс является конфигурацией атомов с ослабленными старыми связями.

Ингибиторы и катализаторы
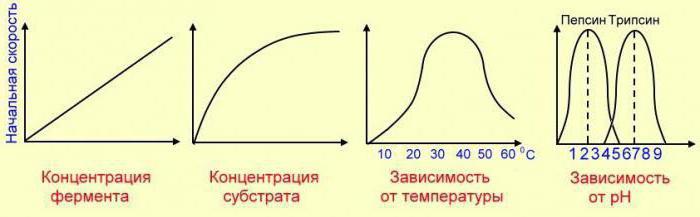
Проанализируем зависимость скорости ферментативной реакции от температуры среды. Такие вещества осуществляют функцию ускорителей процесса.
Сами они не являются участниками взаимодействия, их количество после завершения процесса остается без изменений. Если катализаторы способствуют увеличению скорости реакции, то ингибиторы, напротив, замедляют этот процесс.
Суть этого заключается в образовании промежуточных соединений, в результате чего и наблюдается изменение быстроты протекания процесса.
Заключение
В мире ежеминутно происходят разнообразные химические взаимодействия. Как установить зависимость скорости реакции от температуры? Уравнение Аррениуса является математическим объяснением связи константы скорости и температуры. Оно дает представление о тех значениях энергии активации, при которых возможно разрушение либо ослабление связей между атомами в молекулах, распределение частиц в новые химические вещества.
Благодаря молекулярно-кинетической теории можно предсказывать вероятность протекания взаимодействий между исходными компонентами, рассчитывать скорость протекания процесса. Среди тех факторов, которые оказывают воздействие на скорость реакции, особое значение имеет изменение температурного показателя, процентной концентрации взаимодействующих веществ, площадь поверхности соприкосновения, присутствие катализатора (ингибитора), а также природа взаимодействующих компонентов.


























